
Wetenschap
Onderzoekers ontdekken moleculaire basis van antigeenverwerking voor kankerdoelwit MR1
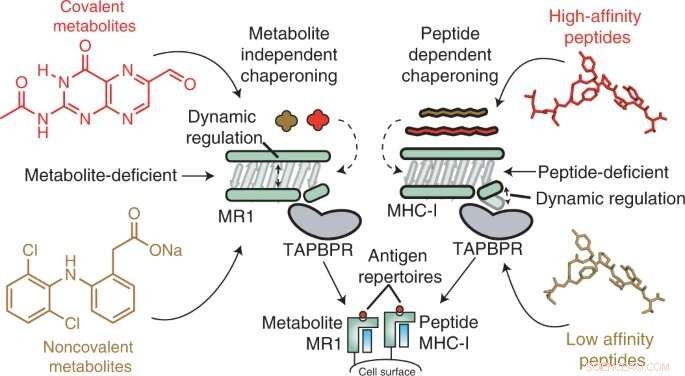
Grafisch abstract. Krediet:Natuur Chemische Biologie (2022). DOI:10.1038/s41589-022-01049-9
In een nieuwe studie gepubliceerd in Nature Chemical Biology , hebben onderzoekers van het Children's Hospital of Philadelphia (CHOP) de moleculaire mechanica onthuld van een celoppervlakmolecuul dat een potentieel doelwit voor immunotherapie is. Met behulp van geavanceerde technieken, waaronder nucleaire magnetische resonantie (NMR) spectroscopie, toonden de onderzoekers het belang aan van zogenaamde chaperonne-moleculen bij het stabiliseren van dit doelwit, bekend als MHC-I-gerelateerd eiwit 1 (MR1).
Major histocompatibiliteitscomplex klasse I (MHC-I) moleculen leven op het oppervlak van bijna alle cellen en presenteren peptide-antigenen aan het immuunsysteem, zodat immuuncellen kunnen detecteren wanneer een vreemd antigeen aanwezig is, zoals die van bacteriën, virussen of zelfs tumoren ontwikkelen. In een soortgelijk proces presenteert het MHC-I-gerelateerde eiwit 1 (MR1) kleinere metabolieten op zijn oppervlak voor bewaking door MR1-specifieke immuuncellen, namelijk mucosaal geassocieerde invariante T (MAIT) cellen.
Van MR1 is bekend dat het belangrijk is voor de herkenning van microbiële infecties, de identificatie van kankercellen in tegenstelling tot gezonde cellen en de regulering van auto-immuunziekten. Recente studies suggereren ook dat MR1 een veel breder scala aan moleculen kan vertonen, waaronder kankerspecifieke metabolieten, die zouden kunnen dienen als interne sensoren voor ziekte. Bovendien varieert MR1 niet in de menselijke populatie, waardoor het een veelbelovend potentieel doelwit voor immunotherapie is. Vóór deze studie was de moleculaire mechanica van MR1 echter onbekend, met name de rol van chaperonne-moleculen bij het herkennen en stabiliseren van MR1-moleculen.
Met behulp van in vitro en in celtechnieken ontdekten de onderzoekers dat MR1 anders werkt dan MHC-I, vooral als het gaat om moleculaire belasting en affiniteit voor de moleculaire chaperonnes Tapasin en TAPBPR. Terwijl MHC-1 een hoge affiniteit voor moleculaire chaperonnes vertoonde wanneer het leeg was, maar een lage affiniteit wanneer het geladen was met presenterende antigenen, interageerde MR1 op even lage niveaus met TAPBPR, of het nu geladen was met metabolieten of niet. Ondanks de korte levensduur van het complex, gebruikten onderzoekers NMR om de 3D-structuur met succes te bepalen in een fysiologisch relevante, waterige omgeving. Interessant is dat deze interacties met lage affiniteit het nog steeds mogelijk maakten dat chaperonnes de lading en uitwisseling van metabolietmoleculen direct op het MR1-oppervlak katalyseren.
"Onze resultaten bieden een basis voor het gebruik van moleculaire chaperonnes om MR1-moleculen te stabiliseren en om het laden en presenteren van antigenen direct op het celoppervlak mogelijk te maken", zegt Nikolaos G. Sgourakis, Ph.D., Associate Professor in het Center for Computational and Genomic Medicine bij Children's Hospital of Philadelphia en senior auteur van de studie. "Toekomstig onderzoek zou bibliotheken van metabolieten moeten screenen om te zien welke een hoge affiniteit vertonen voor binding aan MR1. Onderzoekers kunnen dan manieren overwegen om de oppervlakte-expressie van MR1 te verhogen, mogelijk door stabielere MR1/chaperon-interacties te bevorderen via verschillende benaderingen, zoals het gebruik van kleine moleculen ." + Verder verkennen
Studie onthult dynamiek van cruciale eiwitten van het immuunsysteem
 Ringen maken in natuurlijke antibioticasynthese
Ringen maken in natuurlijke antibioticasynthese Nieuwe generatie materiaal verwijdert jodium uit water
Nieuwe generatie materiaal verwijdert jodium uit water Aangepast polymeer biedt plantaardige bescherming tegen schadelijke zonnestralen
Aangepast polymeer biedt plantaardige bescherming tegen schadelijke zonnestralen Perovskiet-zonnecellen:mogelijke aspecten van hoog rendement ontdekt
Perovskiet-zonnecellen:mogelijke aspecten van hoog rendement ontdekt Moleculaire steiger voor het wijzigen van fluorescerende verbindingen die worden gebruikt in biologische beeldvorming
Moleculaire steiger voor het wijzigen van fluorescerende verbindingen die worden gebruikt in biologische beeldvorming
Hoofdlijnen
- Onderzoek creëert een manier om varkens te beschermen tegen PRRS tijdens de voortplanting
- Waarom herinneren we ons pijn?
- Hoe zijn fotosynthese en cellulaire ademhaling gerelateerd
- Het mysterie van pollenbuisgeleiding ontrafelen
- Hoe u een mRNA-reeks kunt berekenen
- Wat zijn de twee belangrijkste functies van nucleïnezuur in levende wezens?
Nucleïnezuren zijn kleine stukjes materie met grote rollen om te spelen. Genoemd naar hun locatie - de kern - deze zuren dragen informatie die cellen helpt bij het maken va
- Nieuwe mutaties in iPS-cellen zijn voornamelijk geconcentreerd in niet-transcriptionele regio's
- Waarom zijn cellen belangrijk voor levende organismen?
- Argentijnse wetenschappers maken zich zorgen na golf van walvissterfte
- Onderzoekers zetten algenresten om in hernieuwbare producten met flare

- Onderzoekers ontwikkelen een manier om corrosie door ruwe olie beter te voorspellen

- Praktisch gebruik van destillatie

- Vulkaanvormige trend maakt rationeel ontwerp van polysulfidekatalysatoren in lithium-zwavelbatterijen mogelijk
- Haal het meeste uit spinazie - maximaliseer de antioxidant luteïne

 Klimaatscepticus of klimaatontkenner? Het is niet zo simpel
Klimaatscepticus of klimaatontkenner? Het is niet zo simpel De vingerafdruk van de Atlantische Oceaan op het klimaat in het Midden-Oosten
De vingerafdruk van de Atlantische Oceaan op het klimaat in het Midden-Oosten Welke gassen maken de zon op?
Welke gassen maken de zon op?  Invasieve superschurkenkrab kan door zijn kieuwen heen eten
Invasieve superschurkenkrab kan door zijn kieuwen heen eten Doorstroomelektroden maken waterstof 50 keer sneller
Doorstroomelektroden maken waterstof 50 keer sneller Genduplicatie die de celdeling lijkt te vertragen, zorgt ervoor dat Groenlandse walvissen langer leven
Genduplicatie die de celdeling lijkt te vertragen, zorgt ervoor dat Groenlandse walvissen langer leven Een gemakkelijke manier om het skelet te onthouden
Een gemakkelijke manier om het skelet te onthouden  Amerikanen samenbrengen over de kwestie van betaalbare huisvesting
Amerikanen samenbrengen over de kwestie van betaalbare huisvesting
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

