
Wetenschap
Ontdekking van nieuw COVID-infectiemechanisme biedt aanwijzing voor SARS-CoV-2 sprong naar mensen
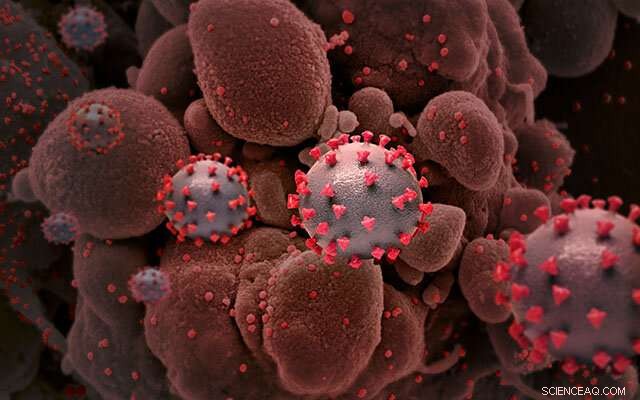
Creatieve weergave van SARS-CoV-2-deeltjes (niet op schaal). Krediet:Nationaal Instituut voor Allergie en Infectieziekten, NIH
De oorspronkelijke SARS-CoV-2-virale stam die begin 2020 opdook, kon zich vasthouden aan suikers die bekend staan als siaalzuren, die op het oppervlak van menselijke cellen worden aangetroffen, een vermogen dat latere stammen niet behielden.
Deze binding werd gevonden met behulp van een combinatie van magnetische resonantie en uiterst nauwkeurige beeldvorming met hoge resolutie, uitgevoerd aan het Rosalind Franklin Institute en de Universiteit van Oxford, en gepubliceerd in het tijdschrift Science deze week.
Dit unieke vermogen in de vroege stam verhoogt ook de mogelijkheid dat dit is hoe het virus voor het eerst is overgedragen van dieren op mensen.
Daaropvolgende varianten van zorg, zoals Delta en Omicron, hebben dit vermogen niet om siaalzuur te grijpen en vertrouwen op receptoren op hun kroonspikes om zich te hechten aan eiwitten die ACE2 worden genoemd op menselijke cellen.
Een internationaal team onder leiding van wetenschappers van het Rosalind Franklin Institute gebruikte magnetische resonantie en complexe beeldvormingstechnieken om verder te onderzoeken. Met behulp van een nucleaire magnetische resonantie (NMR) spectroscopietechniek genaamd saturation transfer difference, ontwikkelden ze een nieuwe, geavanceerde analysemethode om het complexe probleem aan te pakken. Ze hebben de techniek Universal Saturation Transfer Analysis (uSTA) genoemd.
Professor Ben Davis van het Rosalind Franklin Institute en de Universiteit van Oxford, een van de senior auteurs van het artikel, zei:"Twee van de voortdurende mysteries van de coronaviruspandemie zijn de mechanismen achter virale overdracht en de oorsprong van de zoönotische sprong.
"Er zijn aanwijzingen dat sommige griepvirussen siaalzuur op het oppervlak van menselijke gastheercellen kunnen grijpen, en dit is waargenomen bij het Midden-Oosten Respiratory Syndrome (MERS), dat een coronavirus is. dit mechanisme heeft aangetoond, blijkt uit ons onderzoek dat de virale stam die begin 2020 opdook dit zou kunnen gebruiken als een manier om in menselijke cellen te komen."
Het bindingsmechanisme bevindt zich aan het uiteinde van het N-terminale domein, een deel van het virus dat sneller evolueert. Het domein is eerder betrokken geweest bij binding van siaalzuur, maar totdat het team van het Rosalind Franklin Institute precisiebeeldvorming en analyse met hoge resolutie toepast, was dit niet bewezen.
Over de reden waarom het virus de suikerbindende functie heeft weggegooid omdat het zich heeft ontwikkeld tot nieuwe varianten, veronderstelt professor Davis dat het misschien nodig is voor de eerste zoönotische sprong in de mens van dieren, maar dat het dan kan worden verborgen totdat het weer nodig is - met name als de functie in grote lijnen schadelijk is voor de missie van replicatie en infectie van het virus bij mensen.
De bevinding komt overeen met bewijs van de eerste golf in Italië. Het Italian Genomics Consortium zag een verband tussen de ernst van de ziekte van COVID-19 en genetica, aangezien patiënten met een bepaalde genmutatie – een die het type siaalzuur op cellen beïnvloedt – ondervertegenwoordigd waren op intensive care-afdelingen. Dit suggereerde dat het virus sommige genotypen gemakkelijker kon infecteren dan andere.
Professor James Naismith, directeur van het Rosalind Franklin Institute, zegt:"Met onze ultrahoge precisie-beeldvorming en nieuwe analysemethode kunnen we een voorheen onbekende structuur zien helemaal aan het einde van de SARS-CoV-2-piek. Het verbazingwekkende is dat onze bevinding correleert met wat de Italiaanse onderzoekers opmerkten in de eerste golf, wat suggereert dat dit een sleutelrol speelde bij vroege infectie.
"De nieuwe techniek kan door anderen worden gebruikt om licht te werpen op andere virale structuren en om uiterst gedetailleerde vragen te beantwoorden. Dit werk is een voorbeeld van de unieke technologieën die het Rosalind Franklin Institute heeft ontwikkeld." + Verder verkennen
Nanobodies zijn de sleutel tot het in beeld brengen van COVID-19
 Elektrische kabel triggers lichtgewicht, ontdekking van brandwerende bekleding
Elektrische kabel triggers lichtgewicht, ontdekking van brandwerende bekleding Hoe een temperatuurverloop te berekenen
Hoe een temperatuurverloop te berekenen Onderzoek breekt nieuwe wegen in om te begrijpen hoe een moleculaire motor kracht genereert
Onderzoek breekt nieuwe wegen in om te begrijpen hoe een moleculaire motor kracht genereert Nieuwe stafylokokvirulentiefactor
Nieuwe stafylokokvirulentiefactor Door slib aangedreven bacteriën wekken meer elektriciteit op, sneller
Door slib aangedreven bacteriën wekken meer elektriciteit op, sneller
 NASA's infrarood- en radarogen in de ruimte werpen op tropische storm Cindy
NASA's infrarood- en radarogen in de ruimte werpen op tropische storm Cindy Zwitsers houden kielzog op grote hoogte voor verloren gletsjer
Zwitsers houden kielzog op grote hoogte voor verloren gletsjer Schatkamer van nieuwe ontdekkingen benadrukt hiaten in koraalkennis
Schatkamer van nieuwe ontdekkingen benadrukt hiaten in koraalkennis Onderzoeksmodellen presenteren regenvalgegevens om toekomstige voorspellingen te verbeteren van hoe extreem weer het stadsleven zal beïnvloeden
Onderzoeksmodellen presenteren regenvalgegevens om toekomstige voorspellingen te verbeteren van hoe extreem weer het stadsleven zal beïnvloeden Wetenschappers draaien evolutionaire klok terug om CO2-tolerante microalgen te ontwikkelen
Wetenschappers draaien evolutionaire klok terug om CO2-tolerante microalgen te ontwikkelen
Hoofdlijnen
- Twee nieuwe soorten schaaldieren ontdekt op Galicische zeebodem
- Herenbaarden dragen meer bacteriën dan hondenbont,
- De voordelen van Anaerobe Ademhaling
- Halve werelden vogels in verval, soorten die steeds sneller uitsterven
- Nieuwe high-throughput sequencing-technologieën onthullen een wereld van op elkaar inwerkende micro-organismen
- Taxonomie (biologie): definitie, classificatie en voorbeelden
- Het bewijs zit in de voetafdruk:mensen kwamen eerder naar Amerika dan gedacht
- Het combineren van cassavemeel in het brooddeeg kan in de toekomst de toegang tot voedsel verzekeren
- Wat reptielenbotten ons kunnen leren over het gevaarlijke verleden van de aarde
- Goedkoper, minder giftige en recyclebare lichtabsorbers voor waterstofproductie
- Wat is het gas dat wordt uitgestoten bij het verbranden van hout?

- Wetenschappers breiden PET-beeldvormingsopties uit door eenvoudigere chemie
- Wetenschappers analyseren structuur, mechanisme van faageiwit dat elektronen steelt

- Een zeldzame prestatie:materiaal beschermt tegen zowel biologische als chemische bedreigingen
 Smartapparaat detecteert voedselverontreinigingen in realtime
Smartapparaat detecteert voedselverontreinigingen in realtime NASA financiert project om de haalbaarheid te onderzoeken van het gebruik van robotbijen om Mars vanuit een nieuw perspectief te bestuderen
NASA financiert project om de haalbaarheid te onderzoeken van het gebruik van robotbijen om Mars vanuit een nieuw perspectief te bestuderen Onderzoekers beschrijven een wereldwijde gebeurtenis op zeeniveau tijdens het hete broeikasklimaat van het dinosaurustijdperk
Onderzoekers beschrijven een wereldwijde gebeurtenis op zeeniveau tijdens het hete broeikasklimaat van het dinosaurustijdperk Hoe Atwood Machine-problemen Op te lossen
Hoe Atwood Machine-problemen Op te lossen Hout recycle je graag beton?
Hout recycle je graag beton? Volkswagen schakelt met Oliver Blume aan het stuur
Volkswagen schakelt met Oliver Blume aan het stuur Daklozen in Delhi krijgen maskers naarmate de smog erger wordt:officieel
Daklozen in Delhi krijgen maskers naarmate de smog erger wordt:officieel Klimaatverandering zorgt ervoor dat struiken en bomen zich noordwaarts uitbreiden in het subarctische gebied
Klimaatverandering zorgt ervoor dat struiken en bomen zich noordwaarts uitbreiden in het subarctische gebied
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

