
Wetenschap
Virulentiefactor van het influenza A-virus in realtime in kaart gebracht
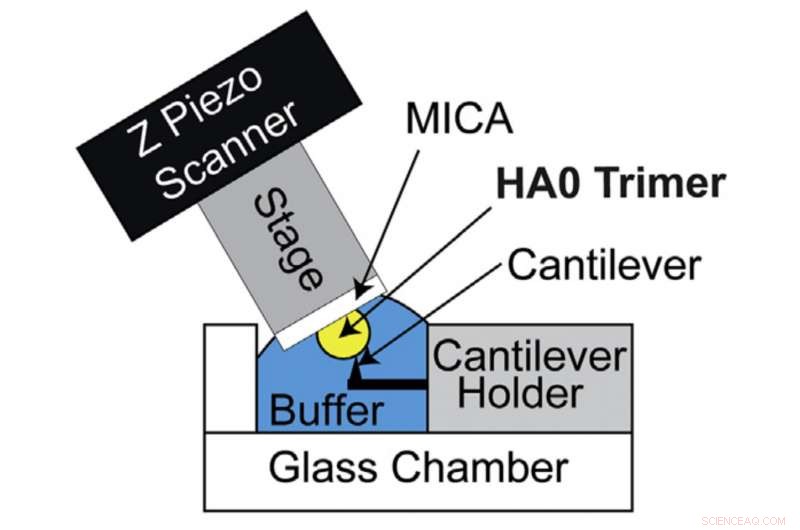
HS-AFM-opstelling voor directe visualisatie van HA0-trimeer. Schematisch diagram van de HS-AFM-opstelling voor het scannen van de HA0-trimeer. Krediet:Universiteit van Kanazawa
De influenza A-virussen, die in het verleden verantwoordelijk waren voor dodelijke pandemieën, vandaag de dag nog steeds een groot mondiaal probleem voor de volksgezondheid. Moleculen die bekend staan als virulentiefactoren worden geproduceerd door bacteriën, virussen, en schimmels om hen te helpen gastheercellen te infecteren. Een van de virulentiefactoren die in de influenza A-virussen worden aangetroffen, is hemagglutinine (HA). Onderzoekers van de Universiteit van Kanazawa hebben onlangs de structuur van HA van het vogelgriepvirus bestudeerd, H5N1, met behulp van high-speed atomic force microscopie (HS-AFM). Hun bevindingen zijn essentieel voor het ontwikkelen van therapeutische benaderingen tegen influenza A-virussen in de toekomst.
HA wordt aanvankelijk gesynthetiseerd door gastheercellen in zijn voorlopervorm die bekend staat als HA0. Conversie van HA0 naar HA hangt af van de pathogeniteit van influenza A-virussen:extracellulaire conversie voor laagpathogene influenza A-virussen en intracellulaire conversie voor hoogpathogene influenza A-virussen. Daarom, het begrijpen van de structuur en eigenschappen van HA0 is van het grootste belang voor het ontcijferen van HA. Zo probeerden Richard Wong en zijn onderzoeksteam HA0 onder de microscoop te onderzoeken. Het recombinante HAO-eiwit van H5N1 werd visueel geanalyseerd door het HS-AFM-systeem ontwikkeld door Kanazawa University.
Zowel HAO als HA bestaan in homotrimere vormen en de omzetting van HAO in HA wijzigt de homotrimere structuur niet significant. Daarom, het is redelijk om HA als sjabloon te gebruiken om HA0 HS-AFM-simulatiebeelden te genereren. Een zure endosomale omgeving is de kritische factor voor HA om fusie te induceren tussen het virale membraan en het endosomale membraan om virale materialen vrij te geven in gastheercellen. Om het zure effect op HA0 op te helderen, het werd voor het eerst blootgesteld aan een zure omgeving. Het trimeer van HA0 bleek erg gevoelig voor de zure oplossing en zette flink uit. Toen conformationele veranderingen van hemagglutinine in realtime werden gemeten met behulp van HS-AFM, het team ontdekte dat het gebied groter was, en de hoogte korter. De zure omgeving maakte het molecuul in wezen platter en meer cirkelvormig, in vergelijking met zijn oorspronkelijke tegenhanger. Deze verandering in exterieur was, echter, omkeerbaar omdat de structuur bij neutralisatie terugkeerde naar zijn oorspronkelijke vorm.
Deze studie maakte de weg vrij voor het in realtime onderzoeken van biologische gebeurtenissen binnen virussen. De auteurs stellen het belang van HS-AFM voor dit onderzoek:"Ons proefwerk stelt HS-AFM vast als een onnavolgbaar hulpmiddel om de dynamiek van virale eiwitten direct te bestuderen, die moeilijk vast te leggen zijn met lage signaal-ruistechnieken die berusten op ensemblemiddeling, zoals cyro-EM en röntgenkristallografie, " zegt hoofdauteur van de studie Dr. Kee Siang Lim. "Met hoge scansnelheid en een minimaal invasieve cantilever, we voorspellen dat HS-AFM haalbaar is om de stroom van onomkeerbare conformationele veranderingen van HA2 geïnduceerd door lage pH te onthullen, die de echte biologische gebeurtenissen nabootst die optreden wanneer HA een gastheerendosoom binnengaat, in toekomstig onderzoek."
 Nieuwe theorie voor hoe sneeuwvlokken groeien
Nieuwe theorie voor hoe sneeuwvlokken groeien Moleculair aas kan hydrogels helpen wonden te genezen
Moleculair aas kan hydrogels helpen wonden te genezen Emissievrije dieselverbranding met een niet-evenwichtsplasma-ondersteund MnO2-filter
Emissievrije dieselverbranding met een niet-evenwichtsplasma-ondersteund MnO2-filter Stampede2, Bridges-simulaties tonen zwakke plekken in Ebola-virus nucleocapsid
Stampede2, Bridges-simulaties tonen zwakke plekken in Ebola-virus nucleocapsid Een manier om een twee-nikkelkatalysator te gebruiken om cyclopentenen te synthetiseren
Een manier om een twee-nikkelkatalysator te gebruiken om cyclopentenen te synthetiseren
 Afbeelding:Flevoland, het gigantische landaanwinningsproject van Nederland
Afbeelding:Flevoland, het gigantische landaanwinningsproject van Nederland Feiten over Fjorden
Feiten over Fjorden  Maritiem continent verzwakt Aziatische tropische moessonregen door Australische stromen over de evenaar
Maritiem continent verzwakt Aziatische tropische moessonregen door Australische stromen over de evenaar Het risicovolle bedrijf van door de overheid beheerde pijpleidingen
Het risicovolle bedrijf van door de overheid beheerde pijpleidingen Nieuwe aanpak kan de voorspelling van zware stormen helpen verbeteren
Nieuwe aanpak kan de voorspelling van zware stormen helpen verbeteren
Hoofdlijnen
- Waarom hebben plantencellen zowel celwanden als celmembranen?
- Ontwikkeling van een zeer nauwkeurig computermodel van het menselijk metabolisme
- Onderzoek wijst achteruitgang van arctische kustvogels aan
- Vissen reageren op aanvallen van roofdieren door de groeisnelheid te verdubbelen
- Waarom zou besnijdenis het risico van een man om AIDS op te lopen verminderen?
- Commensalisme: definitie, types, feiten en voorbeelden
- Wat gebeurt er op het chromosomale niveau als een resultaat van bevruchting?
- Gerst is de smaak van de maand, aangezien nieuwe studie het eeuwenoude brouwdebat beslecht
- Wat u moet weten over mitose voor een test
- Hoe men een deeloplossing met vier delen mengt Water

- DESYs-röntgenbron PETRA III onthult details van adhesieve structuren van spinnenpoten

- Een vetregulerend enzym kan de sleutel zijn tot obesitas, suikerziekte, kanker, andere ziekten
- Betrouwbare detectie van bijsmaken van cacao

- Onderzoek onderzoekt samenspel van eiwitten bij diabetes type 2
 De geheime psychografische tool van Cambridge Analytica is een spook uit het verleden
De geheime psychografische tool van Cambridge Analytica is een spook uit het verleden Wat Katrina ons leerde over het redden van de jongste stormslachtoffers van Puerto Rico
Wat Katrina ons leerde over het redden van de jongste stormslachtoffers van Puerto Rico Eerste waarnemingen van tongvervorming van plasma op basis van de Artsimovich-voorspelling
Eerste waarnemingen van tongvervorming van plasma op basis van de Artsimovich-voorspelling De nadelen van een kleine steekproefgrootte
De nadelen van een kleine steekproefgrootte Halfgeleiderapparaten met een brede bandgap op basis van siliciumcarbide kunnen een revolutie teweegbrengen in de elektronica
Halfgeleiderapparaten met een brede bandgap op basis van siliciumcarbide kunnen een revolutie teweegbrengen in de elektronica Plotselinge opwarming boven Antarctica om de droogte in Australië te verlengen
Plotselinge opwarming boven Antarctica om de droogte in Australië te verlengen Zware stikstofmoleculen onthullen touwtrekken op planetaire schaal
Zware stikstofmoleculen onthullen touwtrekken op planetaire schaal Eenvoudige urinetest maakt gebruik van nanotechnologie om gevaarlijke bloedstolling te detecteren
Eenvoudige urinetest maakt gebruik van nanotechnologie om gevaarlijke bloedstolling te detecteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

