Wetenschap
Gebruikmaken van de structuur van bacteriële gastheercelreceptoren om kanker te detecteren
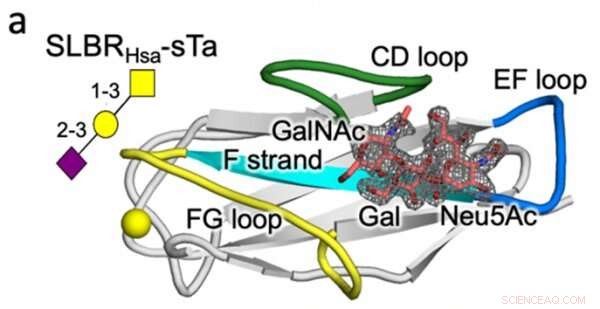
Kristalstructuur van een streptococcus SLBR (Hsa) binding met hoge affiniteit aan de gastheercel glycaanreceptor (sTa). Er wordt voorspeld dat variatie in sequentie en structuur van de gelabelde SLBR-eiwitlussen (CD, EF en FG) de selectiviteit van receptorbinding regelen. Krediet:Vanderbilt University
Bacteriën in ons lichaam binden zich aan verschillende receptoren op het oppervlak van de gastheercel, die bepalen waar de bacteriën leven en hoe ze zich gedragen. Deze receptoren, bestaande uit ketens van suikermoleculen die glycanen worden genoemd, zijn meer dan op het eerste gezicht lijkt. Cellen die bestaan in progressieve ziektetoestanden zoals kanker, kunnen een verhoogd aantal glycaanreceptoren op hun oppervlak hebben.
Het laboratorium van Tina Iverson, Louise B. McGavock-leerstoel en hoogleraar farmacologie, ontdekte het structurele mechanisme waarmee streptokokkenbacteriën zich binden aan glycanen van de gastheercel, wat de deur opent naar nieuwe manieren om bacteriële moleculen te gebruiken om mogelijk kankercellen te detecteren.
Eerder onderzoek heeft aangetoond dat bacteriën zoals streptokokken adhesieve moleculen, SLBR's genaamd, gebruiken om te binden aan glycaanreceptoren op het oppervlak van gastheercellen. Het Iverson-lab veronderstelde dat deze bacteriën de structuur van hun SLBR's kunnen aanpassen om te binden aan een breed scala aan glycaanreceptoren van de gastheer om hen te helpen nieuwe niches in het lichaam te bewonen.
Wat betreft eiwittechnologie, heeft het Iverson-lab bepaald welke structurele SLBR-elementen de keuze van de gastheercelreceptorbinding bepalen. Door het DNA dat codeert voor SLBR's kunstmatig te modificeren en de resulterende eiwitten uit bacteriën te zuiveren, ontdekten ze dat drie lussen in de SLBR - CD, EF en FG genaamd - bepalen aan welke glycanen de bacteriën zullen binden.
Bacteriële hechting aan gastheercelreceptoren is de eerste stap in infectie. Het begrijpen van het mechanisme achter dit proces kan onderzoekers ook helpen bij het identificeren van cellen die zijn verrijkt met oppervlakteglycanen die voorkomen in ziektetoestanden.
Als onderdeel van deze studie ontdekte het Iverson-lab dat commensale bacteriën van de mond binden aan een met suiker bedekt of geglycosyleerd eiwit van de mond dat ook oververtegenwoordigd is in zeer agressieve kankercellen in de meeste carcinomen. Door technieken te ontwikkelen die de selectiviteit van SLBR-glycaan veranderen, is Iverson vastbesloten om een nieuw langetermijndoel aan te pakken:reagentia ontwikkelen die zeer agressieve kankers kunnen identificeren. De glycanen die cellen tot expressie brengen, kunnen dienen als biomarkers om artsen te helpen ziekten op te sporen voor therapeutische interventie.
"We werken aan de uitbreiding van een bibliotheek met glycaanbindende middelen die we in deze studie hebben ontwikkeld, zodat we een groter aantal glycanen kunnen detecteren", zegt Iverson, ook hoogleraar biochemie. "Uiteindelijk zouden we het willen doorontwikkelen tot diagnostische kits."
De studie "Origins of glycan selectivity in streptokokken Siglec-achtige adhesins suggereren mechanismen van receptoradaptatie" werd gepubliceerd in Nature Communications in mei 2022. + Verder verkennen
Suikerketens op celoppervlakken sturen kankercellen om te sterven
 Effect van menselijke activiteiten op het milieu
Effect van menselijke activiteiten op het milieu  Wetenschappers rapporteren techniek om de levensduur van perovskiet-zonnecellen te verlengen
Wetenschappers rapporteren techniek om de levensduur van perovskiet-zonnecellen te verlengen Geometrisch verbijsterende quasikristallen gevonden in het puin van de allereerste nucleaire explosie
Geometrisch verbijsterende quasikristallen gevonden in het puin van de allereerste nucleaire explosie Nieuwe cyclisatiereacties voor het synthetiseren van macrocyclische medicijnleads
Nieuwe cyclisatiereacties voor het synthetiseren van macrocyclische medicijnleads Van oude mineralen tot nieuwe materialen:voorspelling van smelttemperatuur met behulp van een grafisch neuraal netwerkmodel
Van oude mineralen tot nieuwe materialen:voorspelling van smelttemperatuur met behulp van een grafisch neuraal netwerkmodel
 Factoren die van invloed zijn op het ecosysteem
Factoren die van invloed zijn op het ecosysteem  Heroverweeg de impact van bomen op watercycli en klimaat, wetenschappers vragen
Heroverweeg de impact van bomen op watercycli en klimaat, wetenschappers vragen Leven zandduinen echt?
Leven zandduinen echt? Evoluerende perspectieven op abrupte seizoensveranderingen van de algemene circulatie
Evoluerende perspectieven op abrupte seizoensveranderingen van de algemene circulatie Slechte planning door spoorwegen leidt tot verliezen voor boeren
Slechte planning door spoorwegen leidt tot verliezen voor boeren
Hoofdlijnen
- Waar ontwikkelt een Zygote in planten zich in?
- Welke soorten genen hebben plasmiden?
- Wetenschappers onderzoeken mysteries achter diversiteit van DNA-samenstelling tussen soorten
- Microplastics gevonden in commerciële vis uit het zuiden van Nieuw-Zeeland
- Nieuwe studie geeft aan hoe bevruchting veranderingen teweegbrengt in duizenden eiwitten in kikkereieren
- Is diepgevroren kabeljauw net zo lekker als vers?
- Nieuw inzicht in unieke plantchemicaliën kan toekomstige medicijnontwikkeling informeren
- Welke koninkrijken zijn heterotroof en autotroof?
- Twee fasen van fotosynthese
 Wetenschappers voorspellen gedrag van laadstromen in grafeen
Wetenschappers voorspellen gedrag van laadstromen in grafeen Schepen op verzoek lekkage kunnen helpen bij het toedienen van medicijnen
Schepen op verzoek lekkage kunnen helpen bij het toedienen van medicijnen Nieuwe textuur van stikstofmeststof kan nitraatniveaus verlagen, water veiliger maken
Nieuwe textuur van stikstofmeststof kan nitraatniveaus verlagen, water veiliger maken Van een magnetron tot een klok, Amazon brengt Alexa verder dan luidsprekers
Van een magnetron tot een klok, Amazon brengt Alexa verder dan luidsprekers 10 Oorzaken van luchtverontreiniging
10 Oorzaken van luchtverontreiniging  Atmosferische stofniveaus stijgen in de Great Plains
Atmosferische stofniveaus stijgen in de Great Plains COVID-lockdown zorgt voor recorddaling CO2-uitstoot voor 2020
COVID-lockdown zorgt voor recorddaling CO2-uitstoot voor 2020 Woedende Australische bosbranden treffen buitenwijken van Sydney
Woedende Australische bosbranden treffen buitenwijken van Sydney
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com