
Wetenschap
Team onthult verrassende details van cruciaal energieproducerend enzym

Oleh Khalimonchuk van Nebraska heeft geholpen bij het ontrafelen van lang verduisterde details over de vorming van cytochroom-c-oxidase (links), een enzym dat cruciaal is voor het produceren van de energie die allerlei levensondersteunende operaties in de cel aandrijft. Credit:Scott Schrage / Universitaire Communicatie en Marketing
Een nieuwe studie van de Universiteit van Miami en de Universiteit van Nebraska-Lincoln heeft tientallen jaren van doctrine op zijn kop gezet over een enzym waarvan de mutatie of storing op jonge leeftijd dodelijke ziekten kan veroorzaken. Het onderzoeksteam, waaronder Jonathan Dietz en Javier Seravalli uit Nebraska, rapporteerde zijn bevindingen in het tijdschrift Nature Communications .
Dat enzym, cytochroom-c-oxidase, bevindt zich in mitochondriën en fungeert als een toegangspoort tot de cellulaire organellen die het best bekend staan voor het genereren van energie die allerlei levensondersteunende operaties mogelijk maakt. Cytochroom-c-oxidase is ook een van de laatste actoren in een Rube Goldberg-achtige parade van interacties die biochemische valuta - zuurstof en glucose - transporteren en uiteindelijk omzetten in het energieopslagmolecuul dat bekend staat als ATP.
De assemblage van cytochroom-c-oxidase zelf is ook nauwelijks een eenvoudig proces. In feite hebben biochemici jarenlang in elkaar gezet hoe het enorme enzym in elkaar zit.
"Het zijn echt geavanceerde machines", zegt Oleh Khalimonchuk, Susan J. Rosowski hoogleraar biochemie aan Nebraska en een vooraanstaand co-auteur van de studie.
Biochemici onderzochten aanvankelijk het enzym in bacteriën, gisten en andere eencellige organismen die cytochroom-c-oxidase ontwikkelden lang voordat mensen dat deden. Maar de complexiteit van zowel menselijke cellen als het enzym, dat uit meer dan een dozijn subeenheden bestaat, heeft pogingen bemoeilijkt om de assemblage ervan in die cellen te beoordelen. Tot op heden hebben onderzoekers echter aangenomen dat de assemblage van de katalytische kern van het enzym zich bij mensen net zo afspeelt als bij micro-organismen.
Onder leiding van Antoni Barrientos en Eva Nývltová uit Miami nam het Hurricane-Husker-team de slopende taak op zich om één voor één meer dan een dozijn genen te verwijderen die de productie van eiwitten en andere moleculen aansturen waarvan wordt aangenomen dat ze het enzym bij mensen assembleren. Door de resultaten van elke verwijdering achtereenvolgens te analyseren, slaagden de onderzoekers erin om de moleculaire MVP's op de assemblagelijn te identificeren, hun bijdragen aan die assemblage te karakteriseren en hun volgorde van bewerkingen te bepalen met bijna ongeëvenaarde precisie.
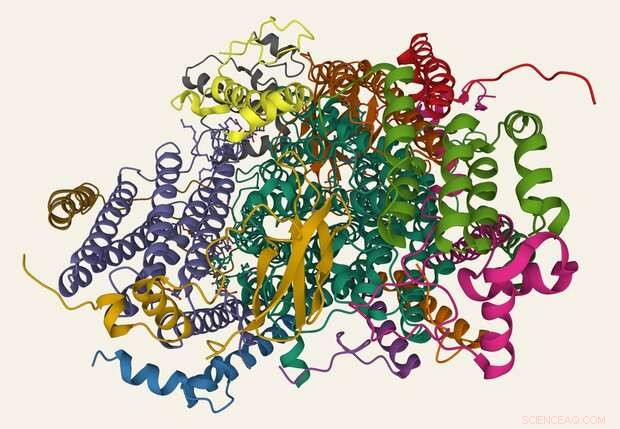
Een weergave van cytochroom c-oxidase. Krediet:Eiwitdatabank
Sommige van wat ze vonden druisten in tegen de lang aanvaarde literatuur van het veld.
"De manier waarop de concepten zijn uiteengezet in onderzoeken naar bacteriën en gisten, blijkt niet precies hetzelfde te zijn in menselijke cellen", zei Khalimonchuk over de componenten die enzymen assembleren. "Ik denk dat dit in feite een decennia oud paradigma verbrijzelt in termen van hoe deze factoren zich gedragen."
Een van de belangrijkste verrassingen kwam in de vorm van COX11, een assemblage-ondersteunend eiwit dat zo belangrijk is in gist dat zonder dat, zei Khalimonchuk, "die mitochondriën dood in het water zijn." In menselijke cellen, zo bevestigde het team, werkt COX11 samen met andere eiwitten om koperatomen in een cel te begeleiden en ze te nestelen in twee kernsubeenheden van cytochroom-c-oxidase. Van daaruit helpen de koperatomen de productie van energieopslaand ATP op gang te brengen door elektronen te accepteren en protonen door te geven aan een mitochondrion.
Maar toen de onderzoekers het gen dat verantwoordelijk is voor COX11 uitschakelden, ontdekten ze dat de resulterende cellen er nog steeds in slaagden ongeveer 15% zoveel cytochroom-c-oxidasen te assembleren als ze gewoonlijk doen, waarbij ze ongeveer 60% van hun gebruikelijke ATP-productie behouden. Het team stelde later vast dat menselijke cellen die COX11 missen, andere eiwitten kunnen oproepen die - ondanks het lagere slaggemiddelde - er effectief voor kunnen knijpen. En toen het team cellen manipuleerde om meer van het knijpende eiwit te produceren dat bekend staat als PET191, steeg de COX11-loze assemblage van cytochroom-c-oxidasen van 15% naar 40%.
"Het loste een raadsel op, omdat veel mutaties in de assemblagefactoren van cytochroomoxidase verband houden met ziekten bij mensen," zei Khalimonchuk. "Er zijn massa's aangeboren ziekten, maar ze waren nog nooit gemeld met een mutatie in COX11 - in tegenstelling tot elke andere factor waarmee we te maken hebben gehad. Dit was zo bizar. Maar nu verklaren deze gegevens eigenlijk waarom:omdat het gedeeltelijk overbodig is ."
Maar Khalimonchuk en zijn collega's concludeerden ook dat COX11, dat zich verbindt met bepaalde eiwitten totdat die eiwitten klaar zijn om koper te begeleiden naar de kernsubeenheden van het enzym, fungeert als een regelgevende beveiliging tegen de langdurige opbouw van giftige moleculen. Dat is vooral belangrijk, zei hij, gezien de explosieve cocktail van zuurstof- en elektronenrijke moleculen die vaak rond mitochondriën wervelen.
"Je kunt oxidase zien als een tijdbom, omdat je al deze dingen hebt die klaar zijn voor onmiddellijke reactie - elektronen accepteren, reageren met zuurstof enzovoort," zei Khalimonchuk. "Dus alles moet worden afgesteld en op zijn plaats komen (op het juiste moment). Als er iets niet klopt - als je een onjuiste assemblage hebt, een aantal weessubeenheden, iets dat wordt blootgesteld aan een omgeving die het niet zou moeten zijn - dat is een echt gevaarlijke situatie. Ze zullen meteen ontsteken, en dat heeft behoorlijk nadelige gevolgen voor een cel.
"Een deel van de reden waarom men denkt dat deze ziekten zo smerig en ingrijpend zijn, is vanwege deze kenmerken van cytochroomoxidase."
Op die manier zal het nauwkeurig onderzoeken van de details van cytochroom-c-oxidase essentieel blijken voor een betere diagnose en uiteindelijk behandeling van de snode ziekten die de disfunctie ervan kan veroorzaken, zei Khalimonchuk. Een zeldzaam maar verwoestend voorbeeld, het Leigh-syndroom, treft het zenuwstelsel van pasgeborenen, die over het algemeen niet meer dan een paar jaar overleven.
"Er is een heel spectrum van aangeboren ziekten," zei Khalimonchuk. "Ze zijn allemaal vroeg begonnen, omdat je vanaf het begin vrij veel moet ademen (en ATP moet produceren). Mitochondriale ziekten zijn over het algemeen vervelend, maar deze zijn bijzonder vervelend."
Om de waarde van op mitochondriën gerichte bevindingen uit te leggen, citeerde Khalimonchuk recent onderzoek dat aantoont dat het toedienen van zuurstof aan patiënten met ernstige mitochondriale ziekten - een veel voorkomende tactiek op eerste hulpafdelingen - eigenlijk schadelijk is.
Dat alleen al vertegenwoordigt vooruitgang, zei Khalimonchuk. Maar om over te gaan van corrigerende middelen en aanbevelingen naar potentieel levensreddende medicijnen, zullen biochemici de kleine lettertjes moeten blijven kammen uit de handleidingen van cytochroom-c-oxidase en mitochondriale machines zoals deze. Dat betekent samenwerking, zei hij, en de bereidheid om de "lange slog" van het zware maar cruciale werk op zich te nemen.
"We hopen dat er meer follow-ups zullen zijn, niet alleen door ons, om dit hele proces nog beter te begrijpen," zei Khalimonchuk, "en misschien nog wat andere ontbrekende stukken te vinden." + Verder verkennen
Architectuur van een bacteriële energiecentrale gedecodeerd
 Welke metalen reageren met water om waterstof te produceren?
Welke metalen reageren met water om waterstof te produceren?  Functionaliseren van niet-geactiveerde alkanen met behulp van reacties op basis van katalysatoren gemaakt van meer overvloedige materialen
Functionaliseren van niet-geactiveerde alkanen met behulp van reacties op basis van katalysatoren gemaakt van meer overvloedige materialen De PKA in titratie
De PKA in titratie Hoe het percentage te berekenen per volume
Hoe het percentage te berekenen per volume Polyethyleen Glycol Vs. Ethylene Glycol
Polyethyleen Glycol Vs. Ethylene Glycol
 Wetenschappers vergelijken bodemmicroben in no-till, conventionele grondbewerkingssystemen van boerderijen in de Pacific Northwest
Wetenschappers vergelijken bodemmicroben in no-till, conventionele grondbewerkingssystemen van boerderijen in de Pacific Northwest Hoe veranderen drones de landbouw?
Hoe veranderen drones de landbouw?  Onderaardse brand:Indonesië worstelt om ondergrondse branden te blussen
Onderaardse brand:Indonesië worstelt om ondergrondse branden te blussen Wetenschappers betwisten ontbrekende drooglandbossen
Wetenschappers betwisten ontbrekende drooglandbossen De 8 geografische regio's van de wereld
De 8 geografische regio's van de wereld
Hoofdlijnen
- Japanse walvisjagers naar Antarctica
- De effectiviteit van camouflage bij verschillende dieren vergelijken
- Zeeleeuwen hebben unieke snorharen waarmee ze zelfs de snelste vis kunnen vangen
- Invasieve soorten reptielen en amfibieën veroorzaken wereldwijd miljarden dollars aan schade
- Onderzoek onthult fylogenie en adaptieve evolutie van zeepokken tot diepzee chemosynthetische habitat
- Wetenschappers ontdekken methode om voedselverspilling om te zetten in biobrandstoffen
- Hoe gaan ziekten van de ene soort naar de andere?
- Nobel werpt licht op paleogenetica, studie van oud DNA
- Isle Royale wolvenpopulatie stijgt nadat ze bijna is uitgestorven
- Onderzoekers ontwikkelen sensoren die menselijke biomarkers en giftig gas detecteren
- Ionische fasen van ammoniakrijk hydraat ontdekt bij hoge dichtheden

- structurele kleuren, zonder de glans

- Neutronen onthullen verborgen geheimen van het hepatitis C-virus
- Operatie in een pil een mogelijke behandeling voor diabetes

 schoner, goedkopere waterstof uit methaan
schoner, goedkopere waterstof uit methaan Zware overstromingen verwoesten West-Afrikaanse landbouwgronden
Zware overstromingen verwoesten West-Afrikaanse landbouwgronden Wetenschappers zien voor het eerst licht van achter een zwart gat
Wetenschappers zien voor het eerst licht van achter een zwart gat  Cumulatieve waarschijnlijkheid berekenen
Cumulatieve waarschijnlijkheid berekenen Auto-onderdelen uit landbouwafval
Auto-onderdelen uit landbouwafval Dichtheid versus Viscositeit
Dichtheid versus Viscositeit Hoe maak je een 1 procent BSA-oplossing
Hoe maak je een 1 procent BSA-oplossing Slapende planten wakker maken met plasma's
Slapende planten wakker maken met plasma's
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

