
Wetenschap
Moleculaire make-over maakt van slap antilichaam een SARS-CoV-2-tacker
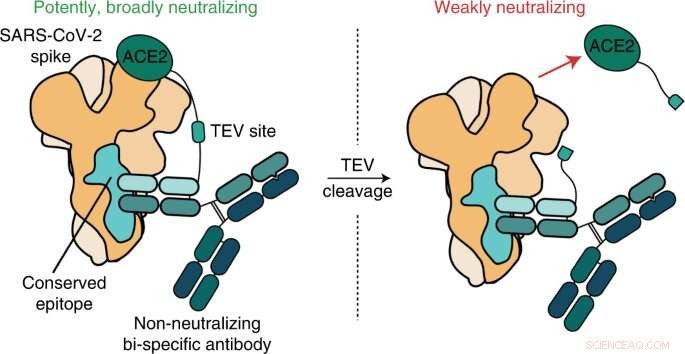
Grafisch abstract. Krediet:Natuur Chemische Biologie (2022). DOI:10.1038/s41589-022-01140-1
Net als de Roadrunner die Wile E. Coyote te slim af is, blijft SARS-CoV-2 (het besmettelijke virus dat verantwoordelijk is voor COVID-19) muteren en nieuwe varianten genereren die uit de greep van een goed getraind immuunsysteem of een goed gericht medicijn kunnen glippen of vaccin.
Nu hebben wetenschappers van Stanford Medicine een manier gevonden om immuunmoleculen die ooit als nutteloos werden beschouwd, te doordrenken met het vermogen om SARS-CoV-2 in een therapeutische blokkade te plaatsen waar het niet uit kan komen. Hun methode wordt beschreven in een artikel dat op 8 september is gepubliceerd in Nature Chemical Biology . De studie werd geleid door bioloog en vaccinoloog Peter Kim, Ph.D.
Twee dingen over het onderzoek vallen op. Ten eerste, hoewel het nog niet klaar is voor gebruik bij mensen, is het een stevige stap in de richting van de ontwikkeling van algemeen effectieve medicijnen die niet stoppen met werken alleen maar omdat een smerig virus een nieuwe truc heeft bedacht. En ten tweede was een belangrijk onderdeel van de nieuwe therapie een molecuul dat routinematig in de prullenbak werd gegooid.
Laten we, om de ontdekking van Kims team ten volle te waarderen, een stapje terug doen en ons afvragen:wat gebeurt er precies als een virus ons lichaam infecteert? En wat doet het immuunsysteem eraan?
De basisprincipes van infectie
Om een infectie te veroorzaken, moet een virus eerst een cel binnendringen. De buitenmembranen van cellen zijn normaal gesproken moeilijk te penetreren zonder een speciale pas. Maar deze kleine kluizenkrakers hebben bedacht hoe ze een slot op het celoppervlak kunnen openen, erin kunnen klimmen, de celreplicatiemachinerie kunnen kapen, talloze kopieën van zichzelf kunnen maken en kunnen ontsnappen om zich naar andere cellen te verspreiden.
Het slot dat SARS-CoV-2 weet te kraken is ACE2, dat verschijnt op het oppervlak van cellen in de keel, longen, hart, nieren, darmen en bloedvaten. ACE2 staat onder andere bekend om het helpen onze bloeddruk laag te houden. Maar SARS-CoV-2 maakt het niet uit wat ACE2 voor de kost doet. Elke cel die ACE2 draagt, is kwetsbaar voor SARS-CoV-2-infectie.
Ons immuunsysteem heeft manieren om met dergelijke indringers om te gaan. Bij het herkennen van de aanwezigheid van een ziekteverwekker, pompen B-cellen, die helpen bij het vormen van ons immuunsysteem, een breed assortiment antilichamen uit die gericht zijn op de indringer. Dit zijn moleculen die bij uitstek geschikt zijn om ziekteverwekkers op te sporen, zoals bijpassende puzzelstukjes, en - als ze op precies de juiste plaatsen terechtkomen en de pasvorm goed is - ze buiten werking stellen.
Antilichamen die uitblinken in het grijpen naar een kenmerk dat cruciaal is voor het succes van de celdeling van de ziekteverwekker, worden "neutraliserend" genoemd:ze voorkomen dat de ziekteverwekker cellen infecteert. Van de beste van deze neutraliserende antilichamen kunnen vervolgens medicijnen worden gemaakt.
Patiënten die met COVID-19 in het ziekenhuis zijn opgenomen, krijgen bijvoorbeeld vaak een dosis monoklonale antilichamen:meerdere kopieën van hetzelfde krachtig neutraliserende antilichaam. Het probleem is dat SARS-CoV-2 bedreven is in het aanpassen van de vormen van zijn kwetsbare kenmerken door te muteren, zodat een eenmaal neutraliserend monoklonaal antilichaam zijn grip verliest en de nieuwe variant niet langer kan onderdrukken. De COVID-19-pandemie was een parade van de ene immuun-ontsnappingskunstenaar na de andere.
Opgevoerd antilichaam
"Het is een domper", zegt Kim, die een groot deel van zijn carrière in de farmaceutische industrie heeft gewerkt. "Je doet al die moeite om deze monoklonale antilichamen te ontwikkelen, ze door klinische proeven te loodsen, productieactiviteiten op te zetten en een noodtoestemming van de FDA te krijgen. Dan, maanden later, verandert het virus en is het monoklonale antilichaam niet meer goed."
Van de meer dan een half dozijn SARS-CoV-2-targeting monoklonale antilichamen die een noodtoestemming hebben gekregen, is er nog maar één in gebruik.
Maar Kims lab heeft een opgevoerd antilichaam dat alle nieuwkomers aankan.
Alle monoklonale antilichamen die de FDA tot nu toe heeft goedgekeurd, houden vast aan het receptorbindende domein van SARS-CoV-2, of RBD. Dat is het "zakelijke einde" van het beruchte spike-eiwit van het virus, het virale uitsteeksel dat knoeit met ACE2 om toegang te krijgen tot cellen. Door nieuwe varianten met gemuteerde RBD's uit te rollen, schudt het virus steeds de greep van opeenvolgende monoklonale antilichamen van zich af.
Maar het SARS-CoV-2 spike-eiwit bevat andere regio's die voor alle praktische doeleinden onveranderlijk zijn. Van deze regio's wordt gezegd dat ze zeer evolutionair geconserveerd zijn, wat betekent dat ze in de loop van de tijd niet zijn veranderd, zelfs niet bij virale stammen die elders verschillen.
Dus waarom zou je niet een monoklonaal antilichaam bedenken dat achter een van die geconserveerde regio's aangaat? Zou dat het probleem van de ontsnappingskunstenaar niet oplossen?
Ja, zei Kim, de Virginia en D.K. Ludwig professor in de biochemie. "Maar tot nu toe heeft niemand een antilichaam tegen een geconserveerd gebied op SARS-CoV-2 gevonden dat geen watje is." Met andere woorden, het lijkt erop dat geen van deze antilichamen krachtige neutraliserende antilichamen zijn - ze blijven maar zitten en rijden mee met het virus, maar voorkomen niet dat het cellen infecteert.
Wimp niet meer
Kim crediteert Payton Weidenbacher, Ph.D., een voormalig afgestudeerde student in zijn laboratorium, met een flits van vindingrijkheid die leidde tot de komst van wat ze "ReconnAbs" hebben genoemd (afkorting van "receptorblokkerende geconserveerde niet-neutraliserende antilichamen") .
Weidenbacher's idee:neem nog een molecuul dat SARS-CoV-2 zou kunnen neutraliseren en bind het aan een van deze slappe maar aanhankelijke antilichamen die zich binden aan een goed geconserveerde plaats op het virale spike-eiwit.
"Veel andere onderzoekers gooiden deze antilichamen gewoon in de vuilnisemmer, en wij ook", zei Weidenbacher.
Ze vonden een antilichaam dat zich richtte op een deel van het spike-eiwit van SARS-CoV2 dat nooit lijkt te veranderen, ongeacht welke nieuwe variant er opduikt. Met behulp van een flexibel eiwitfragment als riem bonden ze dit antilichaam vast aan het stuk ACE2 dat uit het celoppervlak steekt - het deel waar het virus zich aan vastklampt.
"Het is onmogelijk dat SARS-CoV-2 zich een weg kan muteren uit zijn afhankelijkheid van ACE2", zei Weidenbacher.
In een laboratoriumschaal bleek het aangebonden construct in staat om SARS-CoV-2-infectie van menselijke cellen die normaal vatbaar zijn voor het virus, te blokkeren. Het heeft gewerkt op alle SARS-CoV-2-stammen die tot en met BA.2 zijn getest.
De volgende stap is het testen van ReconnAbs op dieren.
Kim kijkt verder dan de huidige pandemie en stelt zich voor dat ReconnAbs dient als een modulaire mix-and-match "onderdelenkit" die snel in actie kan worden gebracht wanneer de volgende pandemie toeslaat om het virus vanaf het begin te stoppen in afwachting van de gehoopte ontwikkeling van nog betere medicijnen.
Zo'n kit zou drie onderdelen bevatten:antilichamen waarvan bekend is dat ze zich stevig vastklampen aan sterk geconserveerde gebieden van welk goed bestudeerd virus dan ook (bijvoorbeeld een coronavirus of griepvirus); welk 'slot' van het celoppervlak dat virus ook weet te kiezen om in onze cellen te komen; en kleine riemen om ze aan elkaar te haken.
"Het was een vleugje creativiteit", zei Kim. "Payton reikte figuurlijk in de vuilnisemmer, haalde deze citroenen eruit en veranderde ze in limonade." + Verder verkennen
Krachtig nieuw antilichaam neutraliseert alle bekende SARS-CoV-2 varianten
 Indonesië belooft actie nadat Brits cruiseschip koraalrif ruïneert
Indonesië belooft actie nadat Brits cruiseschip koraalrif ruïneert Zelfs als hij in de opslag staat, steenkool bedreigt de menselijke gezondheid
Zelfs als hij in de opslag staat, steenkool bedreigt de menselijke gezondheid Studie:klimaatverandering zou buitenwerkers kunnen dwingen om veel eerder wakker te worden
Studie:klimaatverandering zou buitenwerkers kunnen dwingen om veel eerder wakker te worden Klimaatverandering eist tol van Franse oesterkwekers
Klimaatverandering eist tol van Franse oesterkwekers 5 tips om kinderen te leren over duurzaam leven
5 tips om kinderen te leren over duurzaam leven
Hoofdlijnen
- De oproepen van pinguïns worden beïnvloed door hun leefgebied
- Hoe maak je een Paper Mache Cell
- Berekening van RNA-concentratie
- COVID-19-medicijnen blijven aanwezig in afvalwater, kunnen een risico vormen voor in het water levende organismen
- Knoflook kan chronische infecties bestrijden
- Wat zijn de twee hoofdfasen van de celcyclus?
- S-fase: wat gebeurt er tijdens deze subfase van de celcyclus?
- Onderzoeksteam kijkt naar het verleden voor inzichten over de toekomst van megafauna
- Kunnen milieutoxines de biologische klok verstoren?
- Zullen de futures-superbatterijen van zeewater worden gemaakt?
- Een uitgebreide metabole kaart voor de productie van biogebaseerde chemicaliën
- Hoe zwarte bessen kunnen helpen een einde te maken aan slechte (voor de planeet) haardagen

- Wetenschappers ontwikkelen fagocytische protocellen die in staat zijn tot gerichte afgifte van enzymen

- Nieuwe antikankermiddelen kunnen de tumorgroei bij bijna elk kankertype beter onder controle houden
 Planetaire grenzen:interacties in het aardsysteem versterken de menselijke impact
Planetaire grenzen:interacties in het aardsysteem versterken de menselijke impact Kristallen kunnen helpen bij het ontrafelen van mysteries van donkere materie
Kristallen kunnen helpen bij het ontrafelen van mysteries van donkere materie De snelheid van de Bloodhounds 461 mph is groot, maar het team heeft een groter record voor de boeg
De snelheid van de Bloodhounds 461 mph is groot, maar het team heeft een groter record voor de boeg Praten over hoe we praten over de ethiek van kunstmatige intelligentie
Praten over hoe we praten over de ethiek van kunstmatige intelligentie Nieuwe ontwikkeling in contactlenzen voor rood-groene kleurenblindheid met eenvoudige kleurstof
Nieuwe ontwikkeling in contactlenzen voor rood-groene kleurenblindheid met eenvoudige kleurstof Procedures voor het maken van een citroenbatterij
Procedures voor het maken van een citroenbatterij  Objectieve analyse van stress in de klas
Objectieve analyse van stress in de klas Het eerste experimentele bewijs van de voortplanting van plasmaturbulentie
Het eerste experimentele bewijs van de voortplanting van plasmaturbulentie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

