
Wetenschap
Bicyclische eiwitmimetica remmen het oncogen β-catenine
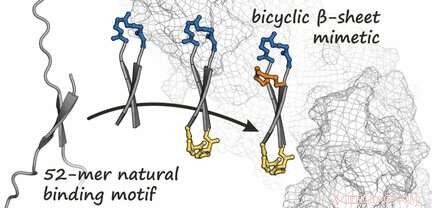
Krediet:Wiley
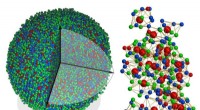
De remming van pathologische eiwit-eiwit interacties is een veelbelovende benadering voor de behandeling van een groot aantal ziekten, waaronder vele vormen van kanker. Een team van onderzoekers heeft nu een bicyclisch peptide ontwikkeld dat bindt aan β-catenine, een eiwit dat wordt geassocieerd met bepaalde soorten tumoren. Het geheim van hun succes is de cyclische aard en de haarspeldvorm van het peptide, die een natuurlijke eiwitstructuur nabootst, ze rapporteren in het journaal Angewandte Chemie .
Vanwege de uitgebreide eiwitgebieden die betrokken zijn bij eiwit-eiwitinteracties, therapeutische benaderingen waarbij kleine moleculen betrokken zijn, zijn vaak niet succesvol. Eiwitmimetica zijn alternatieven die de ruimtelijke structuur van bindingssegmenten van natuurlijke eiwitbindingspartners nabootsen. Hoewel β-sheets - eiwitstructuren gemaakt van verschillende uitgerekte peptideketens die naast elkaar zijn gerangschikt, lijkt op een vel papier dat is gevouwen als een accordeon - spelen vaak een rol bij de interactie van eiwitten, ze zijn zelden gebruikt als basis voor mimetica. Dit komt deels omdat ze problemen hebben om de doelcel binnen te gaan, en daarom, het pathogene eiwit niet kunnen bereiken.
Onder leiding van Tom N. Grossmann, een internationaal team van de Vrije Universiteit Amsterdam (Nederland), Università degli Studi di Napoli "Federico II" (Italië), evenals AstraZeneca (Cambridge, VK), heeft nu het ontwerp gerapporteerd van β-sheet-mimetica die het intracellulaire oncogene eiwit β-catenine remmen. β-Catenine is een onderdeel van de Wnt-signaleringsroute en activeert T-celfactoren (TCF), die uiteindelijk de celgroei en -proliferatie stimuleren. Hyperactivering van de Wnt-route wordt in verband gebracht met verschillende vormen van kanker. Remming van de interactie tussen β-catenine en TCF is dus een aantrekkelijke therapeutische benadering.
Gebaseerd op de bekende structuur van β-catenine wanneer het zich in een complex met een eiwit bevindt, het team produceerde eerst een bindende partner voor β-catenine. Deze partner is een ringvormig peptide dat een korte, antiparallelle β-sheet - bekend als een β-haarspeldstructuur - wanneer het is gebonden aan β-catenine, zoals blijkt uit een analyse van de kristalstructuur. Het idee was om dit cyclische peptide in de haarspeldvorm te fixeren door een extra brug te introduceren. Dit genereert een bicyclische structuur die de binding aan β-catenine versterkt. Door een reeks verschillende gesynthetiseerde varianten te gebruiken, het team was in staat om verschillende bicyclische peptiden te identificeren met een hoge affiniteit voor β-catenine. Tussen deze, ze vonden een verbinding die (anders dan het oorspronkelijke cyclische peptide) met succes cellen binnendringt en de oncogene Wnt-signaalcascade aanzienlijk remt.
Dit nieuw ontwikkelde bicyclische β-sheet-mimeticum vormt dus een mogelijk startpunt voor de ontwikkeling van nieuwe antitumormiddelen die cellulaire Wnt-signalering remmen. Deze strategie zou ook kunnen worden gebruikt voor het ontwerp van verdere remmers van andere eiwit-eiwitinteracties die worden gemedieerd door β-sheets.
 Nieuwe studie vindt onnauwkeurigheden in arseentestkits in Bangladesh
Nieuwe studie vindt onnauwkeurigheden in arseentestkits in Bangladesh Wetenschappers demonstreren hoe staaleigenschappen kunnen worden verbeterd
Wetenschappers demonstreren hoe staaleigenschappen kunnen worden verbeterd Een gemakkelijkere manier om vegetarisch te worden:vitamine B12 kan worden geproduceerd tijdens deegfermentatie
Een gemakkelijkere manier om vegetarisch te worden:vitamine B12 kan worden geproduceerd tijdens deegfermentatie Welke rol speelt chlorofyl in fotosynthese?
Welke rol speelt chlorofyl in fotosynthese?  Hoe lichaamsbeweging kan helpen bij het bestrijden van drugsverslaving
Hoe lichaamsbeweging kan helpen bij het bestrijden van drugsverslaving
 Grote stroomonderbrekingen in Californië omdat wind het brandgevaar vergroot
Grote stroomonderbrekingen in Californië omdat wind het brandgevaar vergroot Zuid-Azië wordt geconfronteerd met een verhoogde dubbele dreiging van extreme hitte, extreme vervuiling
Zuid-Azië wordt geconfronteerd met een verhoogde dubbele dreiging van extreme hitte, extreme vervuiling Hoe zich te ontdoen van Grackles
Hoe zich te ontdoen van Grackles  Om winterregens in het zuidwesten te voorspellen, kijk naar Nieuw-Zeeland in de zomer
Om winterregens in het zuidwesten te voorspellen, kijk naar Nieuw-Zeeland in de zomer Hoe chemische vervuiling te voorkomen
Hoe chemische vervuiling te voorkomen
Hoofdlijnen
- Wetenschappers ontwikkelen nieuwe aanpak om belangrijke onontdekte functies van eiwitten te identificeren
- Genetische aandoeningen: definitie, oorzaken, lijst met zeldzame en veel voorkomende ziekten
- Angst voor haaien beïnvloedt zeewiergroei op Fijische koraalriffen
- Een lijst met vijf kenmerken van chromosomen
- Nieuwe tools helpen bij het zoeken naar levensverlengende chemicaliën
- Structuur van primaire optogenetische tool onthuld
- Chloroplast: definitie, structuur en functie (met diagram)
- Hoe komt glycolyse voor?
- De voordelen van het bestuderen van cellen onder een lichtmicroscoop
- Onderzoekers ontwikkelen geheugenapparaten met faseverandering voor krachtiger computergebruik
- De moeite waard:onderzoekers melden eerste geval van hexagonaal NaCl
- Op weg naar de ontwikkeling van medicijnen voor aan veroudering gerelateerde ziekten
- Hoe de grootte van een Atom

- Eeuwenoud probleem opgelost met allereerste 3D-atomaire beeldvorming van een amorfe vaste stof
 Een toename van bosbranden bedreigt sparren en sparren in Zuidoost-Europa
Een toename van bosbranden bedreigt sparren en sparren in Zuidoost-Europa Efficiëntere methode bedacht voor drugstestatleten
Efficiëntere methode bedacht voor drugstestatleten Hoe maak je een walkie talkie met blikjes en een string
Hoe maak je een walkie talkie met blikjes en een string  Wetenschappers vinden meest vogelachtige dinosaurus ooit gevonden
Wetenschappers vinden meest vogelachtige dinosaurus ooit gevonden Nieuwe NASA-satelliet jaagt op verre planeten
Nieuwe NASA-satelliet jaagt op verre planeten  Afbeelding:Hubble ziet een helder brandend sterrenstelsel
Afbeelding:Hubble ziet een helder brandend sterrenstelsel Hoe dimensies te vinden in geometrische vormen
Hoe dimensies te vinden in geometrische vormen Seksrobots vergroten de kans op gendergerelateerd geweld
Seksrobots vergroten de kans op gendergerelateerd geweld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

