Wetenschap
Op weg naar de ontwikkeling van medicijnen voor aan veroudering gerelateerde ziekten
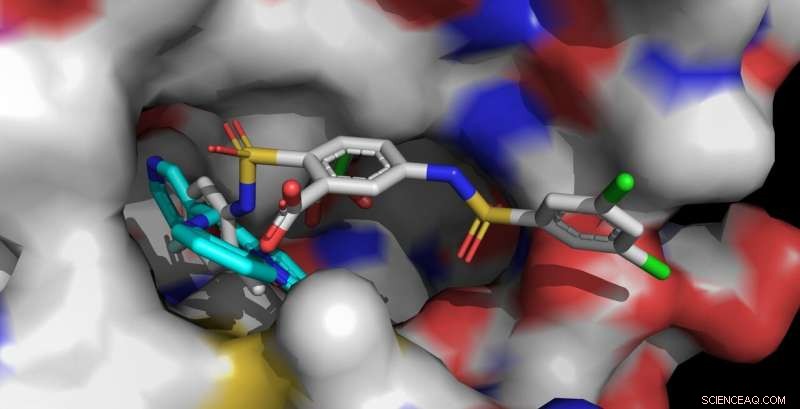
De Sirt6-activatoren UBCS039 (cyaan, linksvoor) en MDL-801 (veelkleurig, rechtsvoor) zijn verankerd in dezelfde bindzak van Sirt6. Het langere MDL-801-molecuul maakt ook contact met aangrenzende oppervlakken en interageert sterker met Sirt6. Krediet:Clemens Steegborn
Bij het zoeken naar manieren om leeftijdsgebonden ziekten bij de mens effectief te bestrijden, het enzym sirtuin 6 (Sirt6) is recentelijk een focus geworden van biochemisch onderzoek. Een gerichte activering van Sirt6 zou dergelijke ziekten kunnen voorkomen of verminderen, bijvoorbeeld sommige soorten kanker. In een paper voor het tijdschrift Natuur Chemische Biologie , biochemici van de Universiteit van Bayreuth hebben nu laten zien hoe het kleine molecuul MDL-801 zich bindt aan het enzym Sirt6 en de activiteit ervan beïnvloedt. Deze bevindingen helpen de ontwikkeling van nieuwe medicijnen.
Het menselijk lichaam bevat zeven verschillende sirtuïnes, genaamd Sirt1 tot Sirt7. Deze enzymen spelen een essentiële rol bij het reguleren van de stofwisseling en stressreacties. In recente jaren, het onderzoeksteam onder leiding van Prof. Dr. Clemens Steegborn aan de Universiteit van Bayreuth heeft in verschillende onderzoeksartikelen laten zien hoe Sirt6 kan worden geactiveerd door kleine moleculen. Met hun studie nu gepubliceerd in Natuur Chemische Biologie , Steegborn en zijn onderzoeksassistent Dr. Weijie You hebben deze bevindingen opgevolgd. Ze ontdekten dat het molecuul MDL-801 een interactie aangaat met Sirt6 door gebruik te maken van een uniek structureel kenmerk van dit enzym:een ongewoon brede bindende pocket die gemakkelijk van buitenaf toegankelijk is en normaal gesproken betrokken is bij interactie met substraateiwitten. Deze moleculaire holte gaat verder in een open kanaal dat naar het katalytische centrum van Sirt6 leidt. Het is in dit kanaal, kenmerkend voor Sirt6, dat MDL-801 verankert wanneer het het enzym activeert. Voornamelijk door middel van activiteitenstudies en röntgenstructuuranalyses, Steegborn en You waren in staat om zowel de bindingsplaats als de moleculaire processen te identificeren die betrokken zijn bij de activering van Sirt6 door MDL-801.
Zoals de biochemici van Bayreuth al in eerdere studies hebben aangetoond, de werkzame stoffen UBCS039, quercetine, en fluvastatine kunnen ook Sirt6 activeren. Om dit te doen, ze gebruiken hetzelfde open kanaal waarin MDL-801 aanmeert. Deze langwerpige holte wordt ook wel het acylkanaal genoemd. Zodra Sirt6 in een geactiveerde staat is, het splitst acylgroepen af van eiwitten. Daarbij, het beinvloedt, onder andere, de synthese van eiwitten gecontroleerd door genen. Bevindingen over de activering van Sirt6 bieden daarom waardevolle aanwijzingen voor de ontwikkeling van werkzame stoffen die verouderingsgerelateerde ziekten kunnen tegengaan, bijvoorbeeld de ontwikkeling van tumoren.
"Alle kleine moleculen waarvan we tot nu toe een activerend effect op Sirt6 hebben kunnen aantonen, gebruiken het acylkanaal om aan Sirtuin 6 te binden. En hoewel hun chemische structuren heel verschillend zijn, ze doen dit op zeer vergelijkbare manieren. Dit biedt ons de mogelijkheid om de details van hun respectieve interacties te gebruiken om activerende verbindingen te verfijnen. Dergelijke medicijnen zouden Sirt6 dan op een specifieke manier kunnen reguleren. Daarbij, ze zouden op een gerichte manier kunnen worden gebruikt om ziekten die verband houden met het verouderingsproces te voorkomen of te genezen, ', zegt Steegborn.
Met hun nieuwe studie Steegborn en You hebben een belangrijke verklaring weerlegd die een onderzoeksgroep in Shanghai publiceerde in Natuur Chemische Biologie in 2018. In dit document MDL-801 werd beschreven als een nieuwe Sirt6-activator. Een röntgenkristallografische structuur werd gebruikt om aan te tonen dat MDL-801 aan een andere moleculaire sectie van Sirt6 bindt dan andere activatoren. "Deze structuur, die het gevolg was van een verkeerde interpretatie van experimentele gegevens, heeft sinds de publicatie ervan talloze onderzoeksteams misleid. Onze studie corrigeert deze fout en maakt het dus mogelijk om efficiënt te werken aan verbeterde activatoren, ', zegt Steegborn.
 Een nieuwe methode om de efficiëntie van kristalhalfgeleiders te kwantificeren
Een nieuwe methode om de efficiëntie van kristalhalfgeleiders te kwantificeren Welke vormen combineren wanneer twee of meer atomen worden gecombineerd?
Welke vormen combineren wanneer twee of meer atomen worden gecombineerd?  Mollen berekenen uit molecuulgewicht
Mollen berekenen uit molecuulgewicht Onderzoekers produceren slimme stof om zenuwgas te neutraliseren
Onderzoekers produceren slimme stof om zenuwgas te neutraliseren Door in een rockster-materiaal te knijpen, kan het stabiel genoeg worden voor zonnecellen
Door in een rockster-materiaal te knijpen, kan het stabiel genoeg worden voor zonnecellen
 Magmaopslag en uitbarstingsgedrag bij vulkaan Bali
Magmaopslag en uitbarstingsgedrag bij vulkaan Bali Bulletin beschrijft bodemonderzoek voor en na brand
Bulletin beschrijft bodemonderzoek voor en na brand Het vaststellen van een tijdschaal voor 10 miljoen jaar geleden
Het vaststellen van een tijdschaal voor 10 miljoen jaar geleden IJsstormen in het Verre Oosten van Rusland leiden tot noodtoestand
IJsstormen in het Verre Oosten van Rusland leiden tot noodtoestand Hoe veranderingen in landgebruik het bruin worden van meren kunnen verminderen
Hoe veranderingen in landgebruik het bruin worden van meren kunnen verminderen
Hoofdlijnen
- Orgelsystemen die betrokken zijn bij homeostase
- Alle informatie die nodig is om proteïnen te maken is gecodeerd in DNA door wat?
- Soorten monomeren
- Welke chemische verbindingen zijn verantwoordelijk voor de smaken van bitter, zuur, zout en zoet?
- Wetenschapsprojecten: een skelet maken
- Wat is een eencellige eukaryoot?
- Sonic Kayaks:Milieumonitoring en experimentele muziek door burgers
- Theory of Evolution: Definition, Charles Darwin, Evidence & Voorbeelden
- Wat doen de Centrioles tijdens de interfase?
Centriolen vormen het microtubulekelet van de cel tijdens de interfase en dupliceren tijdens de S-fase van de interfase, samen met het DNA. Interphase bestaat uit de G1-, S- en G2-fasen. Centriolen komen
 Europese zeebaars vertoont chronische verslechtering na blootstelling aan ruwe olie
Europese zeebaars vertoont chronische verslechtering na blootstelling aan ruwe olie Winst Indiase IT-gigant TCS stijgt met 24 procent
Winst Indiase IT-gigant TCS stijgt met 24 procent Nieuwe methode voor massaproductie van grafeen ontwikkeld
Nieuwe methode voor massaproductie van grafeen ontwikkeld Melkveebedrijven gebruiken te veel water
Melkveebedrijven gebruiken te veel water Kroger rolt zelfrijdende auto's uit voor boodschappenbezorging (update)
Kroger rolt zelfrijdende auto's uit voor boodschappenbezorging (update) VRE4EIC publiceert video-tutorials over het bouwen van virtuele onderzoeksomgevingen
VRE4EIC publiceert video-tutorials over het bouwen van virtuele onderzoeksomgevingen Het onthullen van verborgen fasen van materie door de kracht van licht
Het onthullen van verborgen fasen van materie door de kracht van licht Hubble en Gaia wegen de Melkweg nauwkeurig
Hubble en Gaia wegen de Melkweg nauwkeurig
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com