Wetenschap
Een multidimensionaal beeld van SARS-CoV-2

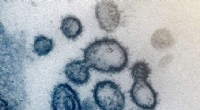
Een massaspectrometerapparaat (detail):met behulp van massaspectrometrische analyse aan het Max Planck Institute of Biochemistry, de onderzoekers ontdekten 1484 interacties tussen virale en menselijke cellulaire eiwitten. Krediet:Sonja Taut/MPI van biochemie
Wat gebeurt er precies als het coronavirus SARS-CoV-2 een cel infecteert? In een artikel gepubliceerd in Natuur , een team van de Technische Universiteit van München (TUM) en het Max Planck Instituut voor Biochemie schetst een uitgebreid beeld van het virale infectieproces. Voor de eerste keer, de interactie tussen het coronavirus en een cel is gedocumenteerd op vijf verschillende proteomics-niveaus tijdens virale infectie. Deze kennis zal helpen om het virus beter te begrijpen en mogelijke aanknopingspunten voor therapieën te vinden.
Wanneer een virus een cel binnendringt, virale en cellulaire eiwitmoleculen beginnen te interageren. Zowel de replicatie van het virus als de reactie van de cellen zijn het resultaat van complexe eiwitsignaleringscascades. Een team onder leiding van Andreas Pichlmair, Hoogleraar Immunopathologie van Virale Infecties aan het Instituut voor Virologie van de TUM, en Matthias Mann, Hoofd van de afdeling Proteomics en Signaaltransductie van het Max Planck Institute of Biochemistry, heeft systematisch vastgelegd hoe menselijke longcellen reageren op individuele eiwitten van de COVID-19-pathogeen SARS-CoV-2 en het SARS-coronavirus, waarvan de laatste al langer bekend is.
Een gedetailleerde interactiekaart
Hiertoe, meer dan 1200 monsters werden geanalyseerd met behulp van de modernste massaspectrometrietechnieken en geavanceerde bio-informatische methoden. Het resultaat is een vrij toegankelijke dataset die informatie geeft over aan welke cellulaire eiwitten de virale eiwitten binden en wat de effecten van deze interacties op de cel zijn. In totaal, 1484 interacties tussen virale eiwitten en menselijke cellulaire eiwitten werden ontdekt. "Hadden we alleen naar eiwitten gekeken, echter, we zouden belangrijke informatie hebben gemist, ", zegt Andreas Pichlmair. "Een database die alleen het proteoom bevat, zou een kaart zijn die alleen de plaatsnamen bevat, maar geen wegen of rivieren. Als je wist van de verbanden tussen de punten op die kaart, je zou veel meer nuttige informatie kunnen krijgen."
Volgens Pichlmair, belangrijke tegenhangers van het netwerk van verkeersroutes op een kaart zijn eiwitmodificaties die fosforylering en ubiquitinatie worden genoemd. Beide zijn processen waarbij andere moleculen aan eiwitten worden gehecht, waardoor hun functies veranderen. In een lijst van eiwitten, deze veranderingen worden niet gemeten, zodat er geen manier is om te weten of eiwitten actief of inactief zijn, bijvoorbeeld. "Door ons onderzoek we wijzen systematisch functies toe aan de afzonderlijke componenten van de ziekteverwekker, naast de cellulaire moleculen die door het virus worden uitgeschakeld, " legt Pichlmair uit. "Er is tot nu toe geen vergelijkbare mapping voor SARS-CoV-2 geweest, ", voegt Matthias Mann toe. "In zekere zin, we hebben vijf dimensies van het virus tijdens een infectie onder de loep genomen:de eigen actieve eiwitten en de effecten op het gastheerproteoom, alomtegenwoordig, fosfoproteoom en transcriptoom."
Inzichten in hoe het virus werkt
Onder andere, de database kan ook dienen als hulpmiddel om nieuwe medicijnen te vinden. Door eiwitinteracties en modificaties te analyseren, kwetsbaarheid hotspots van SARS-CoV-2 kunnen worden geïdentificeerd. Deze eiwitten binden zich aan bijzonder belangrijke partners in cellen en kunnen dienen als mogelijke startpunten voor therapieën. Bijvoorbeeld, de wetenschappers concludeerden dat bepaalde verbindingen de groei van SARS-CoV-2 zouden remmen. Onder hen waren sommigen waarvan de antivirale functie bekend is, maar ook enkele verbindingen die nog niet zijn onderzocht op werkzaamheid tegen SARS-CoV-2. Verdere studies zijn nodig om te bepalen of ze werkzaam zijn bij klinisch gebruik tegen COVID-19.
"Momenteel, we werken aan nieuwe anti-COVID-19 kandidaat-geneesmiddelen, die we door onze analyses hebben kunnen identificeren, ", zegt Andreas Pichlmair. "We ontwikkelen ook een scoresysteem voor automatische identificatie van hotspots. Ik ben ervan overtuigd dat gedetailleerde datasets en geavanceerde analysemethoden ons in staat zullen stellen om in de toekomst gerichter effectieve medicijnen te ontwikkelen en bijwerkingen vooraf te beperken."
 Detectie van een ongekende reeks potentieel schadelijke stoffen in de lucht
Detectie van een ongekende reeks potentieel schadelijke stoffen in de lucht Ingenieurs maken een eenvoudige test die stresshormonen in zweet kan meten, bloed, urine of speeksel
Ingenieurs maken een eenvoudige test die stresshormonen in zweet kan meten, bloed, urine of speeksel Hoe pKa-waarden te berekenen
Hoe pKa-waarden te berekenen  Nieuwe techniek om supersponzen te maken is een game changer
Nieuwe techniek om supersponzen te maken is een game changer Onderzoek biedt hoop op eenvoudigere diagnose en behandeling van kanker
Onderzoek biedt hoop op eenvoudigere diagnose en behandeling van kanker
 Wetenschappers meten nieuwe diepten aan de onderkant van de hydrologische cyclus
Wetenschappers meten nieuwe diepten aan de onderkant van de hydrologische cyclus Nieuwe studie benadrukt de complexiteit van opwarming en smelten op Antarctica
Nieuwe studie benadrukt de complexiteit van opwarming en smelten op Antarctica Planten die in het koraalrif zitten
Planten die in het koraalrif zitten Thailand laat het regenen terwijl vervuiling Bangkok verstikt
Thailand laat het regenen terwijl vervuiling Bangkok verstikt Als het noodlot toeslaat, NASA brengt de kracht van de ruimte
Als het noodlot toeslaat, NASA brengt de kracht van de ruimte
Hoofdlijnen
- De wilde ezel keert terug
- Onderzoek naar roodrugspinnen vindt dat schijnbaar weerzinwekkende paringsstrategie zowel mannen als vrouwen ten goede komt
- Emotionele toestanden ontdekt in vissen
- Haaien spotten drones op patrouille op Australische stranden
- El Nino in de Stille Oceaan heeft invloed op dolfijnen in West-Australië
- Een natte winter kan de invasieve soorten van San Francisco Bay opschudden
- Een genetische opstand in het vroege leven voorkomen
- Hoe malaria het immuunsysteem bedriegt?
- Wat doet de temporale kwab?
 IJsvrije Arctische zomers kunnen afhangen van een klein klimaatopwarmingsbereik
IJsvrije Arctische zomers kunnen afhangen van een klein klimaatopwarmingsbereik Michael verzwakt tot tropische storm na dag van verwoesting in Florida
Michael verzwakt tot tropische storm na dag van verwoesting in Florida VLT doet eerste detectie van titaniumoxide op exoplaneet
VLT doet eerste detectie van titaniumoxide op exoplaneet De Hitomi-satelliet gaf een korte glimp van het heelal,
De Hitomi-satelliet gaf een korte glimp van het heelal,  Controlemethode voor warmteverlies in fusiereactoren
Controlemethode voor warmteverlies in fusiereactoren Wat moeten pijnbomen overleven?
Wat moeten pijnbomen overleven?  Van ontheemde kinderen tot criminele bendeleden:de sociale oorsprong van misdaad opsporen
Van ontheemde kinderen tot criminele bendeleden:de sociale oorsprong van misdaad opsporen Hoe moleculair gewicht om te zetten in dichtheid
Hoe moleculair gewicht om te zetten in dichtheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com