
Wetenschap
Elektrochemische synthese van formiaat uit koolstofdioxide met behulp van een tin/gereduceerde grafeenoxidekatalysator
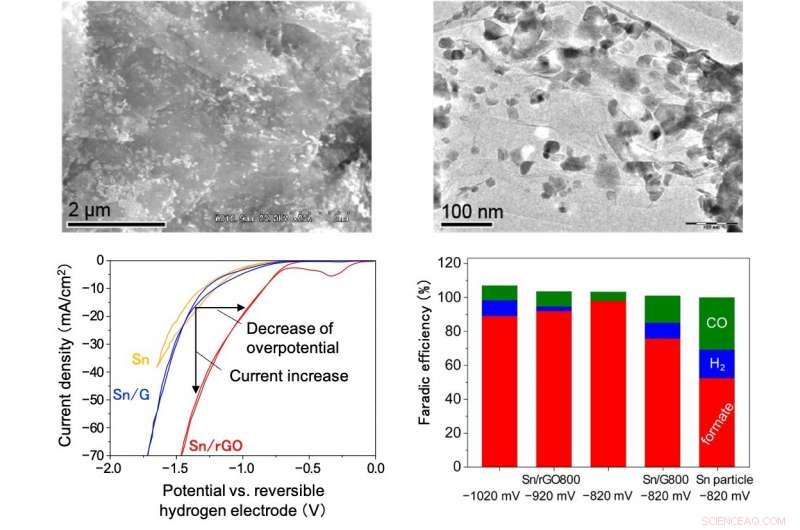
Scanning elektronenmicroscoop afbeelding (linksboven), transmissie elektronenmicroscoop afbeelding (rechtsboven), reductiekenmerken (linksonder) en Faradische efficiëntie (rechtsonder) van de Sn/rGO-katalysator. Het is te zien dat Sn-nanodeeltjes van 10-50 nm uniform zijn verspreid op het gereduceerde grafeenoxidevel (linksboven en rechtsboven). Ook, de absolute waarde van de stroomdichtheid onder CO 2 stroom is groter dan die van de conventionele katalysator (Sn) of Sn-ondersteunde grafeenoxide (Sn/GO), en de stroom neemt toe vanaf een aanvankelijk elektrisch potentiaal met een lagere absolute waarde. Dus, het kan worden gezien dat de overpotentiaal aanzienlijk wordt verminderd en dat de stroomdichtheid wordt vergroot. In aanvulling, de Faradische efficiëntie van formiaat is zeer hoog bij gebruik van de Sn/rGO-katalysator (linksonder en rechtsonder). Krediet:Kanazawa University
Het verminderen van de uitstoot en efficiënt gebruik (fixatie) van kooldioxide (CO 2 ) zijn wereldwijde problemen om de opwarming van de aarde te voorkomen. Bevordering van het gebruik van hernieuwbare energie is effectief in het verminderen van CO 2 uitstoot. Echter, aangezien er grote tijdsafhankelijke schommelingen en grote regionale verschillen zijn in de productie van hernieuwbare energie, het is noodzakelijk om een fixatietechnologie te ontwikkelen om efficiënt energietransport en -opslag mogelijk te maken. Dus, er is toenemende belangstelling voor technologieën om nuttige chemicaliën uit CO . te synthetiseren 2 het gebruik van elektriciteit die is afgeleid van hernieuwbare energie. Vooral, mierenzuur trekt veel aandacht als energie (waterstof) drager omdat het bij kamertemperatuur vloeibaar en niet giftig is. De invoering van deze technologie zal bijdragen aan een efficiënt transport en opslag van hernieuwbare energie en aan de vastlegging van CO 2 , en energieopslag met een hoge milieucompatibiliteit mogelijk te maken.
Bij de elektrochemische reductie van CO 2 , het is bekend dat mierenzuur kan worden verkregen met een Faradisch rendement van ongeveer 50 tot 60% door tin (Sn) als kathodekatalysator te gebruiken. Echter, om deze technologie voor praktisch gebruik te ontwikkelen, verdere verbetering van de Faradische efficiëntie en een vermindering van overpotentiaal zijn noodzakelijk. Er is veel actieve belangstelling voor onderzoek om de ontwerpprincipes van katalysatoren te begrijpen om deze doelen te bereiken.
Het huidige onderzoeksteam onder leiding van Prof. Tsujiguchi en zijn collega's van Kanazawa University in samenwerking met wetenschappers van University of Tsukuba en Osaka University bereidden een tin/gereduceerd grafeenoxide (Sn/rGO) katalysator voor waarin Sn werd ondersteund op gereduceerd grafietoxide door thermische reductie van tinchloride (SnCl 2 ) en grafeenoxide (GO) verkregen door grafietpoeder te oxideren met behulp van de verbeterde Hummers-methode. In de aldus bereide katalysator, Sn is uniform verspreid in de rGO-laag, en de composiet wordt gestapeld om een 3D-morfologie te vormen, d.w.z. rGO/Sn/rGO.
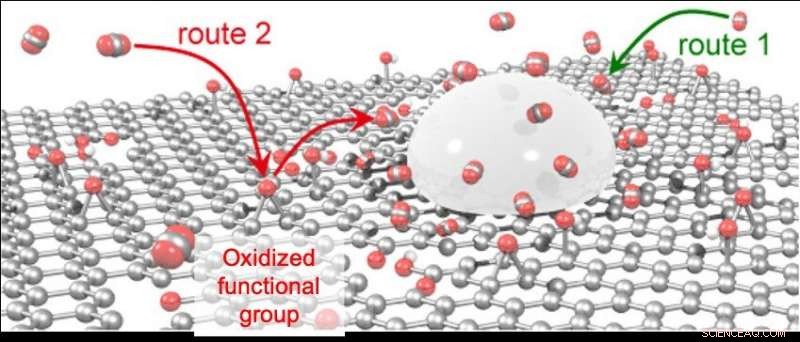
Naast de conventionele route, d.w.z. CO 2 direct geadsorbeerd op Sn (route 1), CO 2 geadsorbeerd op de geoxideerde functionele groepen van rGO wordt geleverd aan Sn (route 2). Krediet:Kanazawa University
Deze katalysator wordt gekenmerkt als een drager met een functionele groep die een veel grotere hoeveelheid zuurstof bevat dan de ter vergelijking gebruikte tin/grafietkatalysator. Toen we de elektrochemische reductie van CO . uitvoerden 2 gebruik van deze katalysatoren met CO 2 opgelost in een oplossing van kaliumwaterstofcarbonaat (KHCO 3 ), er werd gevonden dat de Sn/rGO-katalysator de overpotentiaal significant verminderde en een hoge stroomdichtheid mogelijk maakte in vergelijking met de Sn-katalysator. In aanvulling, wanneer de reductie van CO 2 werd uitgevoerd bij een constant potentieel, bijna geen andere producten dan mierenzuur, zoals H 2 en co, werden gedetecteerd en we slaagden erin om mierenzuur te verkrijgen met een Faradische efficiëntie van 98% (1,8 keer die met Sn-katalysator alleen).
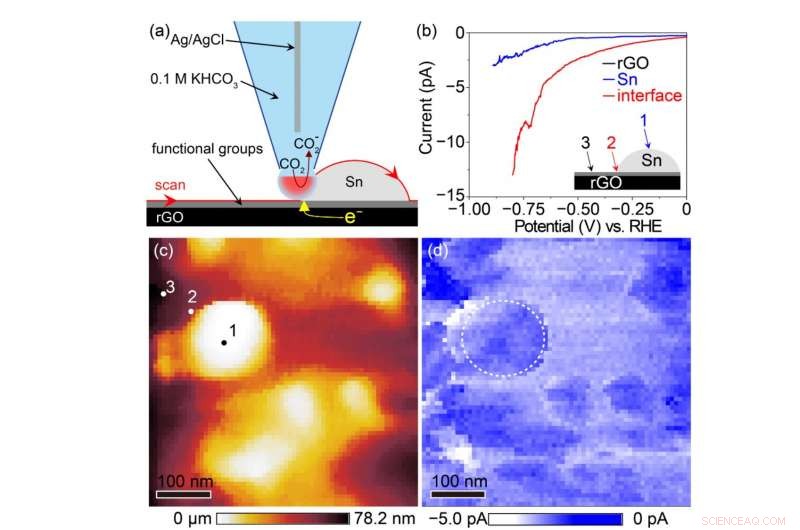
Conceptueel schema van Sn/rGO elektrochemische beeldvorming met een scanning elektrochemische celmicroscoop (linksboven), kenmerken van CO 2 reductie op het rGO-oppervlak, op het Sn-oppervlak, en op de interface tussen Sn en rGO (rechtsboven), topografie onder elektrochemische celmicroscoop (linksonder; 1, op het Sn-oppervlak; 2, op het grensvlak tussen Sn en rGO; 3, op het rGO-oppervlak) en reductiestroomtoewijzing (rechtsonder). Deze figuur laat zien dat CO 2 wordt efficiënt gereduceerd op het grensvlak tussen Sn en rGO. Krediet:Kanazawa University
De reden voor de zeer efficiënte productie van mierenzuur die wordt verkregen met behulp van de Sn/rGO-katalysator is de hoge CO 2 adsorptie capaciteit. Sn/rGO kan vier keer zoveel CO . adsorberen 2 alleen als Sn-katalysator. Verder, de snelheid van CO 2 adsorptie is acht keer die van Sn-katalysator alleen. Computerchemie voorspelde dat deze hoge CO 2 adsorptiecapaciteit zou te wijten zijn aan de geoxideerde functionele groepen van rGO en dat de productie van waterstof en koolmonoxide zou worden onderdrukt omdat de CO 2 geadsorbeerd door de geoxideerde functionele groep van rGO wordt snel en efficiënt geleverd aan het aangrenzende Sn-oppervlak.
Om dit mechanisme experimenteel te bevestigen, ons team probeerde elektrochemische beeldvorming van de katalytische activiteit met een scanning elektrochemische celmicroscoop. Er werd onthuld dat een significant hogere reductiestroomdichtheid werd waargenomen op het grensvlak tussen Sn en rGO dan op de Sn- of rGO-oppervlakken (Fig. 3), wat suggereert dat een grote hoeveelheid mierenzuur wordt gesynthetiseerd op Sn naast rGO, ter ondersteuning van de bovenstaande voorspelling door computationele chemie. Dit is de eerste experimentele demonstratie met behulp van een scanning elektrochemische celmicroscoop dat mierenzuursynthese actief plaatsvindt op het grensvlak tussen de katalysator en de drager. Dus, efficiëntere synthese van mierenzuur zou mogelijk zijn door een drager te combineren met een hoge CO 2 adsorptiecapaciteit met een katalysator voor elektrochemische reductie van CO 2 . Dit biedt een belangrijk raamwerk dat kan worden toegepast op alle tot nu toe beschikbare katalysatoren.
De resultaten van de huidige studie geven nieuwe inzichten in de ontwikkeling van katalysatoren voor de synthese van mierenzuur door de reductie van CO 2 , en er wordt een dramatische vooruitgang verwacht in de ontwikkeling van de technologie voor de synthese van mierenzuur door de elektrochemische reductie van CO 2 . In aanvulling, we hebben een verbetering van de selectiviteit aangetoond door de uitstekende CO 2 adsorptiecapaciteit van de drager en het ophelderen van het reactiemechanisme. Dit zou een grote impact moeten hebben op de elektrochemische reductietechnologie met betrekking tot CO 2 , inclusief de synthese van methanol, methaan en olefinen. Daarom, het heeft de potentie om een bruikbare basistechnologie te zijn bij de synthese van chemicaliën uit CO 2 . In de toekomst, we verwachten dat de ontwikkeling van elektrochemische reductiecellen met deze katalysator zal worden aangemoedigd, wat leidt tot de creatie van apparaten voor energieopslag met een hoge milieucompatibiliteit die kunnen bijdragen aan de fixatie van CO 2 en bevordering van een efficiënt gebruik van hernieuwbare energie.
 Voordelen en nadelen van roestvrijstalen apparaten
Voordelen en nadelen van roestvrijstalen apparaten Kettinglengte bepaalt moleculaire kleur, kleurafstemming voor medische beeldvorming mogelijk maken
Kettinglengte bepaalt moleculaire kleur, kleurafstemming voor medische beeldvorming mogelijk maken Hoe beïnvloedt zure regen gebouwen en standbeelden?
Hoe beïnvloedt zure regen gebouwen en standbeelden?  Nieuw begrip van condensatie kan leiden tot een betere condensor van de elektriciteitscentrale, de-icing materialen
Nieuw begrip van condensatie kan leiden tot een betere condensor van de elektriciteitscentrale, de-icing materialen Oppervlaktewetenschapsconcepten zijn aan herziening toe
Oppervlaktewetenschapsconcepten zijn aan herziening toe
Hoofdlijnen
- Celstructuren en hun drie belangrijkste functies
- Vrouwelijke makaak in Italiaans heiligdom heeft haar gemummificeerde dode baby opgegeten
- De oppervlakte van een cirkel berekenen
- Wat zijn de functies van glasplaat & dekglaasjes?
- Waar bevindt het DNA zich in een cel?
- Klimaatverandering veroorzaakt veranderingen in mariene fanerogame populaties
- Commensalisme:ik profiteer,
- Auxine zorgt voor bladafvlakking
- Procedures voor elektroforese van gel
- Het precieze reactiepad lokaliseren:Methaandissociatie op platina
- Thermische regelaar van polymeer transformeert van geleider naar isolator en weer terug

- Kankercellen vernietigd met metaal van de asteroïde die de dinosauriërs heeft gedood
- Wat planten ons kunnen leren over het opruimen van olievlekken en microfluïdica

- De genen vinden om een betere kankerbehandeling op te bouwen

 Spraakherkenningstechnologie is geen oplossing voor slechte lezers
Spraakherkenningstechnologie is geen oplossing voor slechte lezers Gefossiliseerde algen zijn veelbelovend voor verbeterde voedselveiligheidstesten
Gefossiliseerde algen zijn veelbelovend voor verbeterde voedselveiligheidstesten "Bodies of Water in the Grasslands
"Bodies of Water in the Grasslands Onderzoekers ontdekken een nieuwe fase in blokcopolymeren
Onderzoekers ontdekken een nieuwe fase in blokcopolymeren Spacewalkers voltooien 4 jaar stroomupgrades voor station (update)
Spacewalkers voltooien 4 jaar stroomupgrades voor station (update) Doorbraak belooft aanzienlijk efficiëntere zonnecellen
Doorbraak belooft aanzienlijk efficiëntere zonnecellen Wanneer bazen beledigend zijn, hoe medewerkers hun motieven interpreteren maakt verschil
Wanneer bazen beledigend zijn, hoe medewerkers hun motieven interpreteren maakt verschil Astronoom van Harvard stelt dat buitenaards schip ons een bezoek heeft gebracht
Astronoom van Harvard stelt dat buitenaards schip ons een bezoek heeft gebracht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

