
Wetenschap
Aanpasbaar synthetisch antibioticum verslaat resistente bacteriën
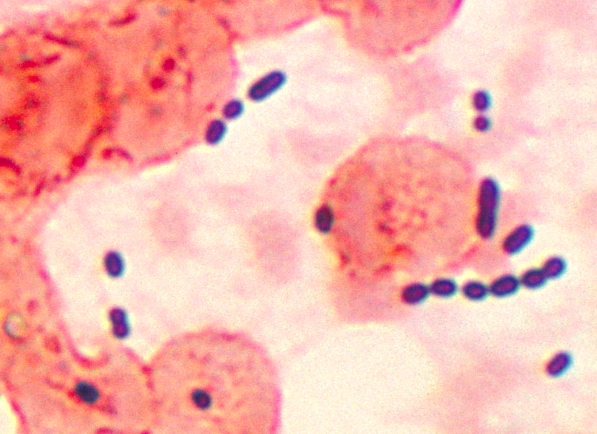
Deze microfoto onthult de cocci-vormige Enterococcus sp. bacteriën genomen van een longontstekingpatiënt. Enterococcus sp. is een veel voorkomende, grampositieve bacterie die normaal in de darm en het vrouwelijke geslachtsorgaan kan worden aangetroffen. Deze bacteriën kunnen worden verspreid door fecaal-orale overdracht, contact met besmette lichaamsvloeistoffen of contact met besmette oppervlakken. Krediet:CDC/publiek domein
Antibioticaresistentie is een van 's werelds meest urgente bedreigingen voor de volksgezondheid. Alleen al in de Verenigde Staten, elk jaar zijn er tienduizenden sterfgevallen als gevolg van resistente stammen van veel voorkomende bacteriën zoals Staphylococcus aureus en Enterococcus faecium, die vrijwel onbehandelbare ziekenhuisinfecties kunnen veroorzaken. Er worden gevaarlijk weinig nieuwe klassen antibiotica ontwikkeld om infecties te bestrijden die resistent zijn geworden tegen traditionele behandelingen, en het op de markt brengen van nieuwe medicijnen kan tientallen jaren duren.
Onderzoekers van UC San Francisco pakken antibioticaresistentie aan met een andere benadering:het herontwerpen van bestaande antibioticamoleculen om de resistentiemechanismen van een bacterie te omzeilen. Door een set moleculaire LEGO-stukken te bedenken die kunnen worden veranderd en samengevoegd om grotere moleculen te vormen, de onderzoekers hebben gemaakt waarvan ze hopen dat het de eerste van vele "herbouwingen" is van medicijnen die waren opgeschort vanwege antibioticaresistentie. Het onderzoek is op 23 september gepubliceerd, 2020, in Natuur.
"Het doel is om klassen medicijnen te doen herleven die hun volledige potentieel niet hebben kunnen bereiken, vooral die waarvan al is aangetoond dat ze veilig zijn bij mensen, " zei Ian Seiple, doctoraat, een assistent-professor in de UCSF School of Pharmacy's Department of Pharmaceutical Chemistry en het Cardiovascular Research Institute (CVRI), en hoofdauteur op het papier. ‘Als we dat kunnen, het elimineert de noodzaak om voortdurend nieuwe klassen medicijnen te bedenken die resistente bacteriën kunnen overtreffen. Het herontwerpen van bestaande medicijnen kan daarbij een essentieel hulpmiddel zijn."
In werk beschreven in het nieuwe Natuur papier, Seiple en zijn medewerker James Fraser, doctoraat een professor in de afdeling Bioengineering en Therapeutische Wetenschappen van de School of Pharmacy in de UCSF School of Pharmacy, hebben deze benadering aangetoond met een klasse antibiotica die streptogramines worden genoemd. Tot voor kort, streptogramines waren zeer effectief tegen S. aureus-infecties, totdat de bacteriën een slim resistentiemechanisme ontwikkelden.
Streptograminen schakelen bacteriën uit door de werken in het bacteriële ribosoom op te ruimen, waardoor het voor de bacteriën onmogelijk wordt om eiwitten te maken. Maar bacteriën die resistent zijn tegen streptograminen, produceren eiwitten die virginiamycine-acetyltransferasen (vaten) worden genoemd, die deze antibiotica herkennen wanneer ze de bacteriecel binnendringen. De vaten grijpen het medicijn en deactiveren het chemisch voordat het aan het ribosoom kan binden. het onbruikbaar maken.
Streptograminen, zoals de meeste andere antibiotica, zijn afgeleid van natuurlijk voorkomende antibiotische verbindingen die worden geproduceerd door andere organismen (meestal bacteriën) die vervolgens worden aangepast om hun prestaties in het menselijk lichaam te optimaliseren. Seiple dacht dat er ook een manier moest zijn om verdere veranderingen aan het medicijnmolecuul aan te brengen, waardoor het de opname door de Vat-eiwitten zou kunnen omzeilen.
Seiple wilde vanaf het begin nieuwe streptograminen bouwen, in plaats van bestaande structuren aan te passen. Om het bouwproces te vergemakkelijken, Qi Li, doctoraat, een postdoctoraal fellow in het Seiple-lab en co-eerste auteur op het papier, creëerde zeven moleculaire modules die naar behoefte kunnen worden aangepast om een reeks variaties op het streptograminemolecuul te bouwen.
"Dit systeem stelt ons in staat om de bouwstenen te manipuleren op manieren die in de natuur niet mogelijk zouden zijn, "zei Seiple. "Het geeft ons een efficiënte route om deze moleculen helemaal opnieuw te ontwerpen, en we hebben veel meer speelruimte om creatief te zijn met hoe we de structuren aanpassen."
Zodra Seiple en Li hun bouwstenen hadden, de volgende stap was om een beeld te krijgen op moleculair niveau van de betrokken chemie om beter te begrijpen hoe je die moleculaire LEGO's kunt aanpassen en samenstellen.
Daarom, Seiple werkte samen met Fraser, die gespecialiseerd is in het maken van visuele modellen van biologische moleculen.
"De bijdrage van mijn lab was om te zeggen, 'Nu je de zeven stukken hebt, welke moeten we aanpassen en op welke manier?'" zei Fraser, wiens werk aan het project werd ondersteund door de inaugurele Sanghvi-Agarwal Innovation Award.
Om antwoorden op die vraag te krijgen, Jenna Pellegrino, een afgestudeerde student in de Fraser Group en co-eerste auteur op het papier, twee complementaire technieken gebruikt, cryo-elektronenmicroscopie en röntgenkristallografie, om driedimensionale afbeeldingen van het medicijn te maken met een bijna atomaire resolutie, evenals zijn doelwit het bacteriële ribosoom, en zijn aartsvijand, het Vat-eiwit.
Met behulp van de modellen, Li, Pellegrino, Seiple, en Fraser kon zien welke delen van het streptograminemolecuul essentieel zijn voor de functie van het antibioticum. Daarna was Li vrij om te spelen met de niet-essentiële regio's van het medicijn om modificaties te vinden die verhinderden dat Vats in wisselwerking stond met het medicijn, terwijl het toch kon binden aan zijn ribosomale doelen en de bacterie kon uitschakelen.
Het team ontdekte dat twee van de zeven bouwstenen potentieel interessante sites voor aanpassing leken te bieden. Ze maakten variaties van het medicijn dat tweaks in die regio's bevatte en ontdekten dat deze variaties activiteit hadden in tientallen stammen van pathogene bacteriën. De onderzoekers testten ook hun meest veelbelovende kandidaat tegen streptogramine-resistente S. aureus in geïnfecteerde muizen, en ontdekte dat het meer dan 10 keer effectiever was dan andere streptogramine-antibiotica.
Seiple wijst erop dat de kennis die is opgedaan door deze samenwerkingsexperimenten kan worden toegepast op het wijzigen van veel andere antibiotica.
"We leerden over mechanismen die andere klassen antibiotica gebruiken om zich aan hetzelfde doelwit te binden, "zei hij. "Bovendien, we hebben een workflow opgezet voor het gebruik van chemie om resistentie tegen antibiotica te overwinnen die hun potentieel niet hebben bereikt."
Seiple zal doorgaan met het verfijnen van deze synthetische streptogramines en hoopt vervolgens het werk te verplaatsen naar de particuliere sector waar de opnieuw ontworpen antibiotica verder kunnen worden ontwikkeld en getest in proeven bij mensen. Hij en Fraser zijn van plan om samen te blijven werken aan het nieuw leven inblazen van andere antibiotica die zijn opgeschort vanwege microbiële resistentie. het verfijnen van een reeks hulpmiddelen die onderzoekers kunnen helpen de bacteriële evolutie een stap voor te blijven.
"Het is een eindeloze wapenwedloop met bacteriën, " zei Fraser. "Maar door de betrokken structuren te bestuderen - voordat er weerstand ontstaat - kunnen we een idee krijgen van wat de mogelijke weerstandsmechanismen zullen zijn. Dat inzicht zal een leidraad zijn voor het maken van antibiotica die bacteriën niet kunnen weerstaan."
Hoofdlijnen
- De effecten van algen in drinkwater
- Klop, klop! Wie is daar?
- Waardoor stinkt de durian-vrucht? Kankerwetenschappers kraken het durian-genoom
- DNA-bewijs zet neushoornstropers achter tralies, studie toont
- Relatie tussen DNA-basen Genen, eiwitten en eigenschappen
- Zal er ooit een gelukkige pil zijn?
- Bacteriën: definitie, soorten en voorbeelden
- Wat zijn emoties,
- Cephalization of Earthworms
- Omgekeerd ontwerp van poreuze materialen met behulp van kunstmatige neurale netwerken
- Doorbraak in elektrolyse van zuur water via katalysatoren op basis van ruthenium

- Engineering van een polymeernetwerk om op verzoek als actieve camouflage te fungeren

- Krachtige nieuwe beeldvormingsmethode onthult in detail hoe deeltjes in oplossing bewegen
- Chirale krabben

 Temperaturen stijgen in het verre noorden van Europa
Temperaturen stijgen in het verre noorden van Europa GRADE-CERQual-benadering toepassen op bevindingen van kwalitatieve bewijssynthese
GRADE-CERQual-benadering toepassen op bevindingen van kwalitatieve bewijssynthese Boek is bedoeld om te heroverwegen hoe moeders in de schoolgaande leeftijd worden onderwezen, bezig met onderwijs
Boek is bedoeld om te heroverwegen hoe moeders in de schoolgaande leeftijd worden onderwezen, bezig met onderwijs De longen kunnen eronder lijden wanneer bepaalde elementen nano gaan
De longen kunnen eronder lijden wanneer bepaalde elementen nano gaan Nieuwe tool detecteert ebola, Marburg snel, gemakkelijk
Nieuwe tool detecteert ebola, Marburg snel, gemakkelijk Het effect van sociale klasse op interpersoonlijke relaties
Het effect van sociale klasse op interpersoonlijke relaties Hoe een Chinese telraam te gebruiken
Hoe een Chinese telraam te gebruiken  Online bibliotheek met eigenschappen helpt bij het maken van veiligere nanomaterialen
Online bibliotheek met eigenschappen helpt bij het maken van veiligere nanomaterialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


