Wetenschap
Wetenschappers ontwikkelen breedspectrumremmers van het griepvirus
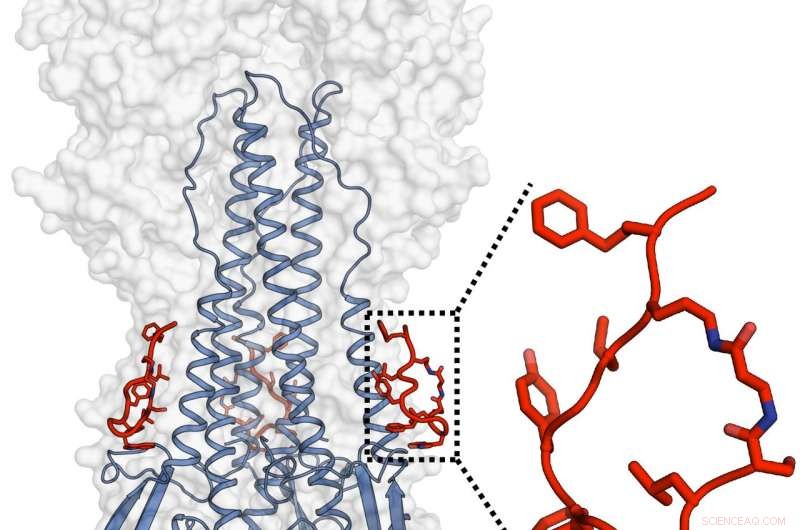
De teams van Janssen en TSRI ontwierpen en karakteriseerden een krachtig peptide dat de functionaliteit van een breed neutraliserend antilichaam nabootste en dat ook in staat was om hemagglutinine van het influenzavirus aan te pakken. Krediet:Rameshwar U. Kadam (Ian Wilson's Lab)
Een team van onderzoekers van The Scripps Research Institute (TSRI) en Janssen Research &Development (Janssen) heeft kunstmatige peptidemoleculen ontwikkeld die een breed scala aan influenzavirusstammen neutraliseren. Peptiden zijn korte ketens van aminozuren - zoals eiwitten maar met kleinere, eenvoudigere structuren. Deze ontworpen moleculen hebben het potentieel om te worden ontwikkeld tot geneesmiddelen die gericht zijn op griep, waardoor tot 500, Jaarlijks vallen er wereldwijd duizenden doden en het kost Amerikanen miljarden dollars aan ziektedagen en productiviteitsverlies.
De ontwikkelde peptiden blokkeren de besmettelijkheid van de meeste circulerende stammen van groep 1 influenza A-virussen, inclusief H5N1, een vogelgriepstam die honderden menselijke infecties en sterfgevallen heeft veroorzaakt in Azië, en de H1N1-varkensgriepstam die in 2009-10 een wereldwijde pandemie veroorzaakte.
De wetenschappers ontwierpen de peptiden om de virusaangrijpende gebieden na te bootsen van twee recent ontdekte "superantilichamen" waarvan bekend is dat ze vrijwel alle influenza A-stammen neutraliseren. Antilichamen zijn grote eiwitten die duur zijn om te produceren en moeten worden toegediend via injectie of infusie. Terwijl, "de peptiden die in het onderzoek zijn ontwikkeld, hebben het potentieel om in de toekomst medicijnen te worden die via pillen op basis van medicijnen worden afgeleverd."
"Het maken van kleine moleculen die in wezen doen wat deze grotere, in het algemeen neutraliserende antilichamen doen, is een echt opwindende en veelbelovende strategie tegen griep, zoals onze nieuwe resultaten laten zien, " zei co-senior onderzoeker Ian Wilson, Hansen hoogleraar structurele biologie aan TSRI.
Het rapport over de nieuwe peptiden verscheen als een online First Release-paper in Wetenschap op 28 sept. 2017.
De twee anti-griep super-antilichamen waarop deze peptiden zijn gebaseerd, genaamd FI6v3 en CR9114, werden ontdekt in 2011 en 2012. Sindsdien Wilson's laboratorium bij TSRI heeft in samenwerking met Janssen en andere structurele biologielaboratoria over de hele wereld op atomaire schaal in kaart gebracht hoe deze en andere algemeen neutraliserende antilichamen zich binden aan griepvirussen.
Een onderzoeksteam onder leiding van David Baker van de Universiteit van Washington heeft onlangs deze antilichaamstructuurgegevens gebruikt om nieuwe eiwitten te ontwerpen. kleiner dan de antilichamen, die zich op een vergelijkbare manier binden aan griepvirussen en een breed scala aan griepstammen neutraliseren. De nieuwe inspanning van TSRI in samenwerking met Janssen-wetenschappers was gericht op de ontwikkeling van nog kleinere niet-eiwitachtige moleculen die hetzelfde doelgebied op griepvirussen zouden raken.
Na verschillende rondes van moleculair ontwerp en synthese, virusbindende testen, en structurele evaluatie op atomair niveau, het onderzoeksteam ontwikkelde een set van vier peptiden met circulaire, "cyclische" structuren die goed presteerden als potentiële griepblokkerende moleculen.
De peptiden vertoonden een hoge bindingsaffiniteit voor een brede set van groep 1 influenza A-virussen, evenals een krachtig vermogen om infecties met deze virussen in laboratoriumexperimenten te neutraliseren. De beoogde groep 1 influenza A-virussen omvatten H1, H2, H5- en H6-subtypen.
De peptiden bevatten ook aminozuurbouwstenen die niet in natuurlijke eiwitten voorkomen, en dit, evenals hun cyclische structuren, maakte ze relatief resistent tegen de enzymen die anders snel peptidegeneesmiddelen uit de bloedbaan kunnen verwijderen. De meest geoptimaliseerde van de vier peptiden, genaamd P7, overleefde uren bij blootstelling aan muis- of menselijk bloedplasma, of wanneer geïnjecteerd in muizen.
"Deze peptiden hebben een medicijnachtige stabiliteit en zullen goede kandidaten zijn voor het verder testen van antivirale werkzaamheid in diermodellen, " zei Rameshwar U. Kadam, een senior postdoctoraal onderzoeksmedewerker in het Wilson Laboratory die samen met Jarek Juraszek co-eerste auteur van de studie is, Principal Scientist bij Janssen.
de peptiden, zoals de antilichamen die ze moeten nabootsen, binden aan een plaats die bekend staat als de hydrofobe stamgroef op het onderste deel van het belangrijkste envelopeiwit hemagglutinine van het griepvirus. De moleculaire structuur op deze plaats varieert meestal niet veel tussen griepstammen, omdat het een cruciale rol speelt in een vormveranderend proces waardoor het virus de gastheercel kan binnendringen en een infectie kan initiëren. Structurele evaluaties door Kadam vonden dat de peptiden deze vormverandering voorkomen en dus de penetratie van gastheercellen voorkomen.
"Een therapie die zich richt op het eerste stadium van infectie zou een aanvulling zijn op de bestaande anti-influenza medicijnen die gericht zijn op latere stadia van infectie, ' zei Kadam.
De peptiden binden niet zo uitgebreid aan hun virale doelwit als de antilichamen waarop ze zijn gebaseerd. Op groep 2 influenza A-virussen, bijvoorbeeld, ze misten het vermogen van de grotere antilichamen om een suikermolecuul op het hemagglutinine opzij te duwen of te vermijden dat een belangrijk deel van de doelsite blokkeert. Echter, Kadam zei dat verdere studies peptiden kunnen opleveren met activiteit tegen zowel groep 1 als groep 2 influenza A en zelfs influenza B-stammen.
"Het is behoorlijk revolutionair dat we structurele informatie over antilichamen konden gebruiken om veel kleinere moleculen te maken die bijna dezelfde bindingsaffiniteit en mate van neutralisatie tegen griepvirussen hebben, ' zei Kadam.
"Er was scepsis in het veld dat we zulke goede resultaten zouden kunnen krijgen met zulke kleine moleculen, maar deze studie bewijst dat we kunnen, ' zei Wilson.
 Onderzoekers vinden bewijs voor metallische waterstof bij 425 gigapascal
Onderzoekers vinden bewijs voor metallische waterstof bij 425 gigapascal Een lasergestuurde programmeerbare contactloze transferdruktechniek
Een lasergestuurde programmeerbare contactloze transferdruktechniek Door de bodem kijken kan boeren helpen om toekomstige droogtes het hoofd te bieden
Door de bodem kijken kan boeren helpen om toekomstige droogtes het hoofd te bieden Onderzoekers bootsen het gietgedrag van gesmolten metaal na met nieuw ontwikkelde simulatietechnologie
Onderzoekers bootsen het gietgedrag van gesmolten metaal na met nieuw ontwikkelde simulatietechnologie Kleine filters helpen bij het opsporen van kankerachtige bloedcellen
Kleine filters helpen bij het opsporen van kankerachtige bloedcellen
 Klimaatverandering vormt een grote bedreiging voor de voedingswaarde van oesters
Klimaatverandering vormt een grote bedreiging voor de voedingswaarde van oesters In de media-aandacht voor klimaatverandering, waar zijn de feiten?
In de media-aandacht voor klimaatverandering, waar zijn de feiten? Amazonebranden zorgen ervoor dat de CO2-uitstoot van Brazilië stijgt tijdens een pandemie
Amazonebranden zorgen ervoor dat de CO2-uitstoot van Brazilië stijgt tijdens een pandemie Hoe de Slingshot-waterzuiveraar werkt
Hoe de Slingshot-waterzuiveraar werkt  De impact van groene eieren en kippen modelleren
De impact van groene eieren en kippen modelleren
Hoofdlijnen
- Sint-jakobsschelpen hebben 200 ogen, die functioneren als een telescoop:studie
- Wetenschappers onthullen superbugs-artillerie
- Prokaryotische versus eukaryotische cellen: overeenkomsten en verschillen
- Beschrijving van de basisfuncties van enzymen in cellen
- Race om Indonesische krokodil te redden die is getroffen door een bandenketting
- Laat me je bladeren zien - Gezondheidscontrole voor stadsbomen
- Verschil tussen plantaardige en dierlijke celdeling
- Geurende reinigingsproducten: The New Smoking?
- De beste manieren om bacteriën te kweken op agar
 Walmart meldt winstsprong, waarschuwt voor tarieven
Walmart meldt winstsprong, waarschuwt voor tarieven Europa:er kan leven zijn op de maan van Jupiter en twee nieuwe missies zullen de weg vrijmaken om het te vinden
Europa:er kan leven zijn op de maan van Jupiter en twee nieuwe missies zullen de weg vrijmaken om het te vinden 3D hiërarchisch poreuze nanogestructureerde katalysator helpt koolstofdioxide efficiënt te verminderen
3D hiërarchisch poreuze nanogestructureerde katalysator helpt koolstofdioxide efficiënt te verminderen Euronext overtreft Nasdaq-bod op de beurs van Oslo
Euronext overtreft Nasdaq-bod op de beurs van Oslo Luchtmacht op zoek naar additieve productie om hypersonische vluchtmogelijkheden uit te breiden
Luchtmacht op zoek naar additieve productie om hypersonische vluchtmogelijkheden uit te breiden Europees-Japanse missie om de kleinste planeet in het zonnestelsel te onderzoeken
Europees-Japanse missie om de kleinste planeet in het zonnestelsel te onderzoeken Hoe werkt een oliepompaansluiting?
Hoe werkt een oliepompaansluiting?  De belangrijkste biotische en abiotische componenten van het ecosysteem van het Great Barrier Reef
De belangrijkste biotische en abiotische componenten van het ecosysteem van het Great Barrier Reef
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com