
Wetenschap
S-glutathionylering van door mensen induceerbaar Hsp70 onthult een regulerend mechanisme met betrekking tot het C-terminale α-helix deksel
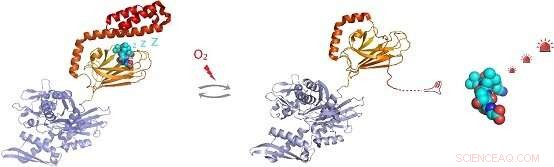
Afbeelding:Onder oxidatieve stressomstandigheden, de moleculaire chaperonne Hsp70 ondergaat post-translationele modificatie van cysteïneresiduen door toevoeging van het tripeptide glutathion. Glutathionylering binnen het substraatbindende domein van Hsp70 zorgt ervoor dat het C-terminale helixvormige gebied van Hsp70 zich ontrafelt en zijn eigen substraatbindingsplaats inneemt. Dit voorkomt binding, waardoor activering van signaalmolecuulsubstraten zoals de hitteschoktranscriptiefactor Hsf1. Credit:de groep van Dr. Sarah Perrett
Heat shock protein 70 (Hsp70) eiwitten zijn een familie van oude en geconserveerde moleculaire chaperonnes. Ze spelen een essentiële rol bij het handhaven van de eiwithomeostase, inclusief het vergemakkelijken van eiwitvouwing en -afbraak, het voorkomen van eiwitaggregatie, en deelnemen aan de stressreactie. Verstoring van de cellulaire kwaliteitscontrolemachines wordt geassocieerd met veroudering, kanker en neurodegeneratieve ziekten.
De rol van post-translationele modificaties (PTM's) bij het reguleren van de functies van Hsp70 is een opkomend onderzoeksgebied. Hoewel oxidatieve stress schadelijk kan zijn, redoxvariatie is een natuurlijk kenmerk van de cellulaire omgeving en vergemakkelijkt de signaaltransductie voor belangrijke fysiologische activiteiten. Cysteïnemodificaties van eiwitten vormen het belangrijkste middel voor de overdracht van redoxsignalen. Glutathionylering is een omkeerbare modificatie van cysteïneresiduen in eiwitten, die eiwitten kunnen beschermen tegen onomkeerbare oxidatie, en kan ook een rol spelen bij signaaltransductie.
In dit onderzoek, glutathionylatie van verschillende Hsp70-familieleden werd gedetecteerd in HeLa-cellen en de modificatieplaatsen werden vastgesteld met massaspectrometrie door onderzoekers van prof. Sarah Perrett en prof. Chen Chang's groep aan het Instituut voor Biofysica van de Chinese Academie van Wetenschappen.
Focussen op stress-induceerbare Hsp70 HspA1A (hHsp70), het gedetailleerde structurele mechanisme van hoe glutathionylatie de eiwitactiviteit en eiwit-eiwitinteracties beïnvloedt, werd onderzocht.
In vivo detectie toonde aan dat elk van de vijf cysteïneresiduen van hHsp70 glutathionylatie kan ondergaan. In vitro-experimenten hebben aangetoond dat modificatie van cysteïnes in het nucleotide-bindende domein van hHsp70 wordt voorkomen door nucleotide-binding, maar dat Cys-574 en Cys-603, gelokaliseerd in het C-terminale α-helix deksel van het substraatbindende domein, kan glutathionylatie ondergaan in zowel de aanwezigheid als afwezigheid van nucleotide.
Door de NMR-structuur van de glutathionyleerde vorm van het hHsp70 SBD op te lossen, de structurele basis voor de functionele veranderingen werd aangetoond. Glutathionylering van deze cysteïneresiduen resulteert in het ontvouwen van de a-helix-lidstructuur. Het ongevouwen gebied bootst substraat na door te binden aan en de substraatbindingsplaats te blokkeren, waardoor intrinsieke ATPase-activiteit wordt bevorderd, en concurreren met binding van externe substraten. Dit leidt tot een vermindering van het vermogen om andere substraateiwitten te binden, zoals de hitteschokfactor Hsf1.
Deze resultaten geven niet alleen aan dat cysteïnemodificatie de structuur en functie van hHsp70 kan veranderen, maar ook dat hHsp70 redox-informatie kan overdragen aan zijn klanten.
Deze studie is gepubliceerd in de Tijdschrift voor biologische chemie op 12 juni 2020.
 Ambrosia-verbindingen kunnen zenuwcellen beschermen tegen Alzheimer
Ambrosia-verbindingen kunnen zenuwcellen beschermen tegen Alzheimer Video:Hoe werkt airconditioning?
Video:Hoe werkt airconditioning? Verbetering van de piëzo-elektrische microscopiekarakterisering van keramische materialen
Verbetering van de piëzo-elektrische microscopiekarakterisering van keramische materialen Ontwikkeling van een vast materiaal dat langzaam waterstofsulfide en stikstofmonoxide kan afgeven
Ontwikkeling van een vast materiaal dat langzaam waterstofsulfide en stikstofmonoxide kan afgeven Hoe bouw je een Atom Science Project
Hoe bouw je een Atom Science Project
 Natuurlijk kapitaal een ontbrekend stuk in klimaatbeleid
Natuurlijk kapitaal een ontbrekend stuk in klimaatbeleid De grondoorzaken van natuurrampen begrijpen
De grondoorzaken van natuurrampen begrijpen NASA vindt potentieel voor zware regenval in nieuwe tropische cycloon Pola
NASA vindt potentieel voor zware regenval in nieuwe tropische cycloon Pola Fossiele bomen op het centrale Andesplateau van Peru vertellen een verhaal over dramatische veranderingen in het milieu
Fossiele bomen op het centrale Andesplateau van Peru vertellen een verhaal over dramatische veranderingen in het milieu Pandemie:minder luchtvervuiling betekent dat er duizenden minder sterven
Pandemie:minder luchtvervuiling betekent dat er duizenden minder sterven
Hoofdlijnen
- Nieuw onderzoek lost een van de meest verhitte geschillen over evolutionaire biologie op robuuste wijze op
- Transformatief onderzoek onrealistisch om te voorspellen, wetenschappers vertellen subsidieverstrekkers
- Virussen bestrijden:codebrekers worden codeschrijvers
- Genetisch manipulatiemechanisme gevisualiseerd
- Vergelijking voor glucosemetabolisme
- De chemische samenstelling van voedingsstoffen Agar
- Hoe ribosomen het proteoom vormen
- Welke soorten organische moleculen vormen een celmembraan?
- Mitosis: definitie, stadia en doel
- Chemicus creëert nieuwe katalysatoren voor klikreacties
- Kleine borstels die oppervlakken glad maken, werken mogelijk niet zoals bedoeld, studie vondsten

- Vloeibare schokdempers

- Hoe houden Van der Waals-krachten moleculen bij elkaar?

- Nieuwe methode biedt stabieler, efficiënte elektrokatalytische reacties
 Oorzaak en gevolg Wetenschapsprojecten
Oorzaak en gevolg Wetenschapsprojecten Hoe waarschijnlijk is het dat consumenten kunstmatige intelligentie gebruiken voor bankadvies?
Hoe waarschijnlijk is het dat consumenten kunstmatige intelligentie gebruiken voor bankadvies? Superresolutiesysteem onthult mechanica van kleine DNA-walker
Superresolutiesysteem onthult mechanica van kleine DNA-walker UC Berkeley-team geeft springende robot hogere doelen dan bouncy-bouncy
UC Berkeley-team geeft springende robot hogere doelen dan bouncy-bouncy Wetenschappers wijzen schuldigen aan het decimeren van Frances oesters
Wetenschappers wijzen schuldigen aan het decimeren van Frances oesters Nieuwe bevinding van deeltjesfysica kan de afwezigheid van antimaterie helpen verklaren
Nieuwe bevinding van deeltjesfysica kan de afwezigheid van antimaterie helpen verklaren Zoogdierhersenen identificeren type geur sneller dan ooit werd gedacht
Zoogdierhersenen identificeren type geur sneller dan ooit werd gedacht IT-bedrijven zouden meer vrouwen moeten werven voor betere teamprestaties
IT-bedrijven zouden meer vrouwen moeten werven voor betere teamprestaties
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

