Wetenschap
Hoe ribosomen het proteoom vormen
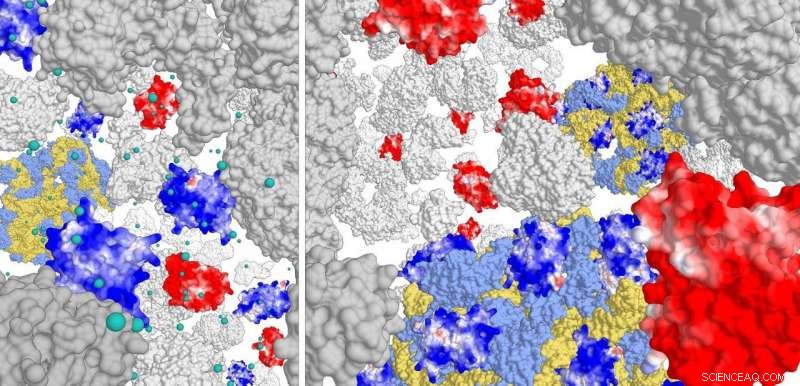
Rechter paneel:interactie van positief geladen eiwitten (donkerblauw) met het ribosoomcomplex (lichtblauw/geel). Negatief geladen eiwitten hebben geen interactie. Bij hoge ionsterkte (linker paneel) interageren de positieve eiwitten nauwelijks met het ribosoom. Krediet:Poolman-lab, Rijksuniversiteit Groningen
Cellen zitten vol met macromoleculen, die de diffusie van eiwitten beperkt, vooral in prokaryotische cellen zonder actief transport in het cytoplasma. Bij het onderzoeken van de relatie tussen crowding, ionsterkte en eiwitdiffusie, Biochemici van de Rijksuniversiteit Groningen deden een fascinerende ontdekking:positief geladen eiwitten kleven aan het oppervlak van ribosoomcomplexen. Dit verklaart waarom de meeste in water oplosbare eiwitten een algehele negatieve lading dragen. De ontdekking verschijnt binnenkort in het tijdschrift eLife .
De bewegingssnelheid van eiwitten in cellen is belangrijk:veel processen in biologische cellen zijn afhankelijk van interacties tussen macromoleculen (eiwitten en nucleïnezuren) en dus van hun vermogen om elkaar te vinden. 'Maar het celcytoplasma is een bruisende plek en dit zal invloed hebben op de eiwit- en RNA-diffusie', merkt Rijksuniversiteit Groningen hoogleraar biochemie Bert Poolman op.
Kosten
Zijn groep bestudeerde de effecten van crowding op diffusie, en vond een correlatie tussen eiwitgrootte en diffusiesnelheid. 'Maar voor sommige eiwitten vonden we deze correlatie niet, dus gingen we onderzoeken waarom.' Het team gebruikte drie verschillende prokaryoten met toenemende ionsterkte:de Gram-negatieve bacterie Escherichia coli, de Gram-positieve Lactococcus lactis en de extremofiele Haloferax volcanii, die bij zeer hoge zoutconcentraties leeft.
Voor deze studie is construeerden de onderzoekers verschillende varianten van Green Fluorescent Protein (GFP), met oppervlakteladingen variërend van -30 tot +25. Vervolgens bestudeerden ze de beweging van deze GFP-varianten in de drie celtypen. 'We zagen dat positief geladen eiwitten heel langzaam diffunderen. Ze kwamen vast te zitten in de cel', legt Poolman uit. Nadere analyse toonde aan dat de positieve eiwitten niet binden aan het DNA of het celmembraan maar aan het ribosoomcomplex.
Interessant
Een bioinformatica-analyse van de proteomen van micro-organismen en eukaryote cellen toonde aan dat in de meeste gevallen ongeveer 70 procent van de eiwitten negatief geladen is. 'Interessant, de overige 30 procent zijn membraaneiwitten of eiwitten die betrokken zijn bij het functioneren of vouwen van het ribosoom of mRNA.'
De membraaneiwitten worden tijdens de biogenese afgeschermd door chaperonnes, zodat ze niet aan de ribosomen blijven plakken. Er zijn dus geen 'vrije' cytoplasmatische eiwitten met een voldoende hoge positieve lading om ze op ribosomen te laten bezinken. De negatieve lading van het ribosoomcomplex en de omringende ionsterkte van het cytoplasma lijken de evolutie van ladingen in het cellulaire proteoom te hebben gevormd.
Niet verwacht
Het nieuwe en onverwachte inzicht dat eiwitmobiliteit een functie is van eiwitlading, kan verklaren waarom het moeilijk is om sommige eiwitten tot expressie te brengen in bacteriële systemen met een lage ionsterkte. 'We zagen dat een hogere ionsterkte de plakkerigheid van positief geladen eiwitten vermindert. Dat zou een waardevol inzicht kunnen zijn voor de constructie van eiwitexpressieplatforms.'
Een laatste observatie in de eLife-paper is dat de genomen van verschillende endosymbionten een overvloed aan positief geladen eiwitten vertonen. 'Deze bevinding verbijstert ons echt', geeft Poolman toe. 'Je zou verwachten dat al die eiwitten aangetrokken worden door de endosymbionten ribosomen. Tot dusver, we hebben geen verklaring hoe deze organismen kunnen omgaan met langzame diffusie en ribosomen die worden overspoeld met positieve eiwitten.'
 Omzetting van kooldioxide naar methanol
Omzetting van kooldioxide naar methanol Vier grootste verschillen tussen de oceaan en zoet water
Vier grootste verschillen tussen de oceaan en zoet water Een nieuw lid in de AIE-familie
Een nieuw lid in de AIE-familie Methode om microfluïdische elektrochemische technologieën toe te passen op redox-neutrale reacties met één elektronoverdracht
Methode om microfluïdische elektrochemische technologieën toe te passen op redox-neutrale reacties met één elektronoverdracht Organische elektronica:wetenschappers ontwikkelen een hoogwaardige unipolaire n-type dunne-filmtransistor
Organische elektronica:wetenschappers ontwikkelen een hoogwaardige unipolaire n-type dunne-filmtransistor
 Machine learning maakt mobiele microscoop mogelijk voor het bewaken van de luchtkwaliteit
Machine learning maakt mobiele microscoop mogelijk voor het bewaken van de luchtkwaliteit De effecten van bodemverontreiniging op het milieu
De effecten van bodemverontreiniging op het milieu  Insecticide en klimaatopwarming hebben invloed op insectengemeenschappen
Insecticide en klimaatopwarming hebben invloed op insectengemeenschappen Arctisch zee-ijs laat opnieuw flink smelten
Arctisch zee-ijs laat opnieuw flink smelten Ongebruikelijke feiten over het Forest Ecosystem
Ongebruikelijke feiten over het Forest Ecosystem
Hoofdlijnen
- Coole ideeën voor een 3D-model van DNA
- Vier belangrijke soorten chromosomen
- Hoe schimmel te identificeren in petrischalen
- Als het gaat om de dreiging van uitsterven, grootte doet er toe
- Wat zijn enkele kenmerken van DNA?
- Wat is een homologe eigenschap?
- Krachten van spinnengif onderzocht in VR-game
- Complexere biologische systemen evolueren vrijer
- Wat is een gespecialiseerd gebied van het endoplasmatisch reticulum?
 Hoe een geen onbewerkte gegevens, geen enkele wetenschappelijke visie kan de reproduceerbaarheidscrisis in de wetenschap oplossen
Hoe een geen onbewerkte gegevens, geen enkele wetenschappelijke visie kan de reproduceerbaarheidscrisis in de wetenschap oplossen Het potentieel van het vreemd gevormde molecuul benutten
Het potentieel van het vreemd gevormde molecuul benutten Motivatie is een belangrijke factor bij het al dan niet spieken van leerlingen
Motivatie is een belangrijke factor bij het al dan niet spieken van leerlingen de dodelijke, levengevende en voorbijgaande elementen die deel uitmaken van groep 15 van het periodiek systeem
de dodelijke, levengevende en voorbijgaande elementen die deel uitmaken van groep 15 van het periodiek systeem VS zetten zich in voor emissiereducties, op zijn eigen voorwaarden:officieel
VS zetten zich in voor emissiereducties, op zijn eigen voorwaarden:officieel Programma's voor financiële educatie, inkomensafhankelijke aflossingsplannen bevorderen de welvaart
Programma's voor financiële educatie, inkomensafhankelijke aflossingsplannen bevorderen de welvaart Droogte in Duitsland kan extremer worden, volgens historische gegevens over megadroogte
Droogte in Duitsland kan extremer worden, volgens historische gegevens over megadroogte Nieuwe laser laat silicium zingen
Nieuwe laser laat silicium zingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com