
Wetenschap
Minuscule moleculaire bewegingen kunnen leiden tot efficiëntere biobrandstofcellen
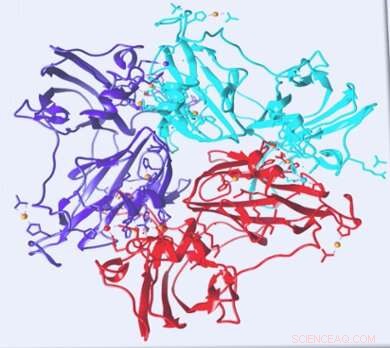
Credit:Universiteit Leiden
Leidse onderzoekers hebben minuscule bewegingen gevonden in het laccase-enzym. Deze ontdekking zou kunnen leiden tot de ontwikkeling van veel efficiëntere biobrandstofcellen. publicatie in Biofysisch tijdschrift .
Het laccase-eiwit-enzym is een zeer efficiënte katalysator, wat het interessant maakt voor gebruik in biobrandstofcellen. Het laccase-enzym is in staat om efficiënt water te maken uit zuurstof zonder waterstofperoxide aan te maken. een onstabiele verbinding die biobrandstofcellen zou beschadigen. Omdat eiwitten vaak instabiel zijn, wetenschappers hebben geprobeerd de eigenschappen van laccase te recreëren in duurzamere anorganische verbindingen.
Hoewel deze nieuwe anorganische verbindingen steviger zijn dan de oorspronkelijke eiwitten, ze zijn niet zo efficiënt. Een nieuwe ontdekking door Leidse scheikundigen opent nieuwe mogelijkheden om de anorganische replica's te verbeteren.
Tot nu toe, wetenschappers beschouwden laccases als nogal rigide en hebben anorganische replica's gemaakt om even stevig te zijn. Chemicus Rubin Dasgupta en anderen van het Leiden Institute of Chemistry (LIC) hebben minuscule bewegingen in het eiwit ontdekt die kunnen bijdragen aan de efficiëntie van laccase.
Microseconden
Deze kleine bewegingen vinden plaats op de zogenaamde actieve plaats van het enzym, het exacte punt op het eiwit waar chemische reacties plaatsvinden. Rubin Dasgupta legt uit hoe hij de kleine bewegingen ontdekte:"We gebruikten nucleaire magnetische resonantiespectroscopie om naar de actieve plaats van het laccase-eiwit te kijken. We ontdekten dat laccase maar heel weinig beweegt. Deze bewegingen duren slechts milliseconden, wat suggereert dat ze betrokken kunnen zijn bij de reactie."
Volgens Dasgupta, deze dynamiek kan verantwoordelijk zijn voor het geleiden van protonen en elektronen naar de juiste plaats tijdens een chemische reactie. Omdat de anorganische replica's zijn ontworpen om stijf te zijn, ze missen de mogelijkheid om deeltjes op dezelfde manier te geleiden. Dit kan hun lagere efficiëntie gedeeltelijk verklaren in vergelijking met natuurlijke laccase.
Bacterieel eiwit
Laccases werden voor het eerst ontdekt in de negentiende eeuw, maar het specifieke eiwit Dasgupta-onderzoek werd in 2004 ontdekt. Hoewel de meeste bestudeerde laccases afkomstig zijn van schimmels, dit specifieke enzym kwam van de bacterie Streptomyces coelicolor.
Dasgupta:"We hebben voor dit specifieke eiwit gekozen omdat het een aantal voordelen heeft ten opzichte van schimmellaccases. Normale laccases worden inactief in aanwezigheid van zout of hoge alkaliteit. Dit Streptomyces-eiwit blijft actief in zoute of alkalische omstandigheden. Als we in staat zijn om een anorganische replica die zowel de kleine bewegingen nabootst en bestand is tegen hoge pH, het zal mogelijk zijn om een hele nieuwe reeks efficiënte biobrandstofcellen te ontwerpen."
 Wetenschappers vinden optimale leeftijd van stamcellen
Wetenschappers vinden optimale leeftijd van stamcellen Nieuwe techniek lokaliseert locaties van individuele moleculen in hun cellulaire buurten
Nieuwe techniek lokaliseert locaties van individuele moleculen in hun cellulaire buurten Kokosolieverbindingen stoten insecten beter af dan DEET
Kokosolieverbindingen stoten insecten beter af dan DEET De factoren vinden die de staalcorrosie in gewapend beton het meest beïnvloeden
De factoren vinden die de staalcorrosie in gewapend beton het meest beïnvloeden Feiten over convectiestromen
Feiten over convectiestromen
 Duizenden evacueren vanwege historische overstromingen in het midden van Michigan
Duizenden evacueren vanwege historische overstromingen in het midden van Michigan Waar komt collageen vandaan?
Waar komt collageen vandaan?  Feiten over de Catawba River Basin in North Carolina
Feiten over de Catawba River Basin in North Carolina  Door de mens gemaakte vezels en plastic gevonden in de diepste levende organismen
Door de mens gemaakte vezels en plastic gevonden in de diepste levende organismen PFAS aanwezig in de hele Yadkin-Pee Dee riviervoedselketen
PFAS aanwezig in de hele Yadkin-Pee Dee riviervoedselketen
Hoofdlijnen
- Wat is de belangrijkste primaire producent in het mariene ecosysteem?
- Afnemende babyzangvogels hebben bossen nodig om droogte te overleven
- Genetische veranderingen helpen muggen om aanvallen van pesticiden te overleven
- Wat is de Western Blot-test?
- Hoe Royal Jelly wordt geoogst?
- Een sleutel vinden om geblokkeerde differentiatie in microRNA-deficiënte embryonale stamcellen te ontgrendelen
- Zeester maakt comeback nadat syndroom miljoenen heeft gedood
- Nieuw apparaat zoomt in op microbengedrag op de juiste schaal
- Waarom zetten we de radio zachter als we verdwaald waren?
- Verbetering van de elektronenoverdracht in enzymatische biobrandstofcellen
- Een legering die zijn geheugen behoudt bij hoge temperaturen

- 'S Werelds langste flessenborstelpolymeer ooit gesynthetiseerd
- Eigenschappen van CO2-clathraathydraat
- We hebben in minuten zonder hitte diamanten gemaakt door de kracht van een asteroïdebotsing na te bootsen
 Een in, twee uit:Efficiëntere zonnecellen simuleren
Een in, twee uit:Efficiëntere zonnecellen simuleren Deep-learning systeem detecteert menselijke aanwezigheid door RF-signalen te oogsten
Deep-learning systeem detecteert menselijke aanwezigheid door RF-signalen te oogsten De dikte van aluminiumfolie berekenen
De dikte van aluminiumfolie berekenen Wetenschappers lossen mysterie op over hoe de meeste antimaterie in de Melkweg wordt gevormd
Wetenschappers lossen mysterie op over hoe de meeste antimaterie in de Melkweg wordt gevormd Schotlands examenresultaatcrisis:beoordeling en sociale rechtvaardigheid in een tijd van COVID-19
Schotlands examenresultaatcrisis:beoordeling en sociale rechtvaardigheid in een tijd van COVID-19 Canadese Radarsat-satellieten gelanceerd aan boord van SpaceX-raket
Canadese Radarsat-satellieten gelanceerd aan boord van SpaceX-raket Hoe een vuur te maken met een batterij en draad
Hoe een vuur te maken met een batterij en draad  Moleculen gebruiken om nanodrums te ontstemmen
Moleculen gebruiken om nanodrums te ontstemmen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

