
Wetenschap
Nieuwe techniek lokaliseert locaties van individuele moleculen in hun cellulaire buurten
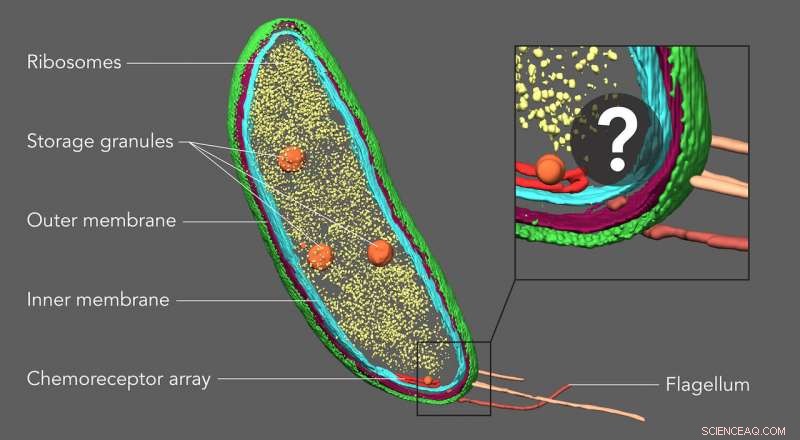
Wetenschappers van Stanford University dachten dat een schijnbaar leeg gebied aan het ene uiteinde van de Caulobacter-bacterie twee eiwitten zou kunnen bevatten die betrokken zijn bij celdeling. Door de eiwitten te labelen met fluorescerende tags en diezelfde monsters vervolgens in beeld te brengen met cryo-elektronentomografie, ze konden deze locatie bevestigen en precies laten zien hoe de eiwitten waren gerangschikt. Krediet:Peter Dahlberg et al., PNAS , 8 juni 2020
Wetenschappers hebben twee van de krachtigste microscopietechnieken van vandaag met elkaar gecombineerd om beelden te maken die lokaliseren, Voor de eerste keer, de identiteiten en precieze locaties van individuele eiwitten binnen de gedetailleerde context van bacteriële cellen. Deze informatie is cruciaal om te leren hoe eiwitmoleculen samenwerken om celdeling te organiseren en andere belangrijke taken uit te voeren, zoals microben in staat stellen voedsel en gevaar op te snuiven.
De nieuwe methode heeft al nieuwe informatie opgeleverd over bacteriële eiwitten en hun nabijgelegen cellulaire buurten. Onderzoekers zeggen dat het ook de potentie heeft om fundamentele vragen te beantwoorden over de moleculaire machinerie van virussen, parasieten, en processen zoals fotosynthese.
"Dit is een grote sprong voor de biologie, en ik denk dat er veel zijn, veel systemen die baat hebben bij dit soort beeldvorming, " zei Stanford-professor Lucy Shapiro, wiens onderzoeksgroep heeft deelgenomen aan het onderzoek.
De nieuwe hybride methode, zogenaamde gecorreleerde beeldvorming door annotatie met enkele moleculen, of CIASM (uitgesproken als "kloof"), is ontwikkeld door Peter Dahlberg, een postdoctoraal onderzoeker in het laboratorium van professor W.E. Moerner aan de Stanford University.
Het is een variatie op een techniek genaamd lage temperatuur microscopie met één molecuul. drie decennia geleden uitgevonden door Moerner, die gloeiende labels aan moleculen hecht, zodat ze individueel kunnen worden geïdentificeerd. Deze methode ligt ten grondslag aan superresolutie fluorescentiemicroscopie, het onderwerp van Moerner's 2014 Nobelprijs voor de Scheikunde.
Wat Dahlberg deed, was een manier vinden om dit type fluorescentiebeeldvorming te laten werken bij temperaturen onder het vriespunt, zodat dezelfde monsters ook konden worden onderzocht met cryogene elektronentomografie (CET). CET gebruikt elektronenstromen om 3D-beelden te maken van snel bevroren cellen en hun componenten met een bijna atomaire resolutie. Door CET te combineren met de fluorescerende beeldvorming kunnen wetenschappers de gelabelde moleculen zien in de context van de omringende cel, een cruciaal perspectief voor het begrijpen van hun rol in de cellulaire machinerie.
"We kunnen specifieke moleculen van belang labelen, zodat het licht dat we zien alleen van die moleculen komt, en dan vinden we waar ze zijn binnen ongeveer 10 nanometer, of miljardsten van een meter. Dit geeft ons een veel nauwkeuriger beeld van wat er aan de hand is, "Zei Dahlberg. "We hebben de ultraprecieze snapshots gemaakt door CET en een klein beetje kleur toegevoegd."
Hij voegde toe, "Het is spannend om nieuwe beeldvormingsmethoden te ontwikkelen. Als je klaar bent, je mag een stap terug doen en kijken naar alle nieuwe vragen die je kunt aanvallen."
Met CIASM, het onderzoeksteam was in staat om de locaties van drie soorten eiwitten te lokaliseren in CET-afbeeldingen met hoge resolutie van bacteriën die zijn genomen in het SLAC National Accelerator Laboratory van het Department of Energy. De resultaten werden gerapporteerd in de Proceedings van de National Academy of Sciences vandaag.
"Elke methode heeft zijn voor- en nadelen, "Moerner zei, "en dit is een mooie situatie waarin we twee methoden kunnen combineren om meer te leren."
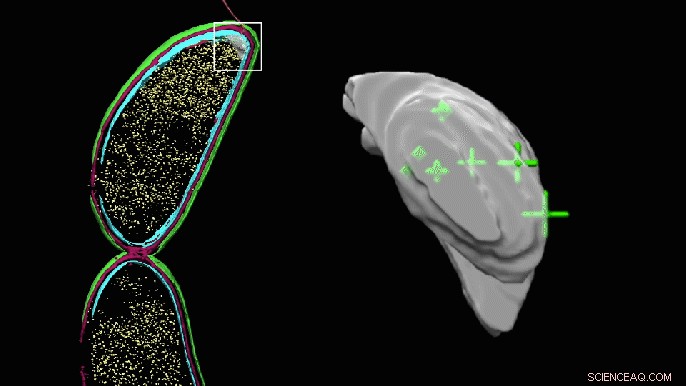
Een roterend 3D-beeld van de schijnbaar lege zak aan het ene uiteinde van een Caulobacter-cel toont nu de precieze locaties van PopZ-moleculen. Het zakje ziet er klonterig uit omdat het handmatig is ingekleurd om het gebied te markeren waar onderzoekers dachten dat de moleculen zouden kunnen zijn, maar kon niet direct identificeren in cryo-elektronentomografie. Krediet:Peter Dahlberg et al., PNAS , 8 juni 2020
Orde vinden in een cellulaire soep
Zelfs in relatief eenvoudige bacteriële cellen, locatie is alles, zei Saumya Saurabh, een postdoctoraal onderzoeker in het lab van Shapiro die een leidende rol speelde in het onderzoek.
"Mensen hebben de neiging om bacteriën te zien als zakken met eiwitten zonder organisatie, ' zei hij. 'Maar het blijkt niet waar te zijn, en in feite zijn veel van de moleculen in bacteriën precies gelokaliseerd in zowel ruimte als tijd. Als ze niet op de goede plek zitten, de cel sterft. Wat Pete's werk ons uiteindelijk in staat stelt, is met moleculaire resolutie naar binnen kijken en uitvinden wanneer en waar deze moleculen zich ten opzichte van elkaar bevinden."
Caulobacter crescentus, bijvoorbeeld, een goed bestudeerde soort zoetwaterbacteriën, staat bekend om de verdeling in twee zeer verschillende soorten dochtercellen:de ene zwemt vrij, terwijl de andere een stengel vormt en aan een oppervlak hecht. Hoe elke dochtercel krijgt wat hij nodig heeft om zijn unieke pad te volgen, is een al lang bestaand mysterie geweest.
Wetenschappers hadden eerder kleine gebieden aan beide uiteinden van de delende cel geïdentificeerd die eiwitten zouden kunnen bevatten die een sleutelrol spelen in deze scheve celdeling. Een van de eiwitten, PopZ, bevindt zich aan beide uiteinden van de delende cel, terwijl de andere, SpmX ("Spam-X") wordt alleen gevonden in de helft die een stengel zal ontwikkelen.
Voor deze studie is Saurabh en afgestudeerde student Jiarui Wang labelden eiwitten in Caulobacter met fluorescerende tags. Toen bevroor Dahlberg deze monsters, heeft fluorescentiebeelden met één molecuul op hen uitgevoerd met de hulp van afgestudeerde studente Annina Sartor, en nam ze mee naar de Stanford-SLAC Cryo-EM-faciliteiten voor CET-beeldvorming onder leiding van Wah Chiu, een professor aan Stanford en SLAC.
Een eiwit-hangout in kaart brengen
De gecombineerde beelden bevestigden niet alleen dat beide eiwitten zich in de gebieden bevonden die wetenschappers hadden vermoed, maar onthulde ook precies hoe ze waren gerangschikt:SpmX was ingebed in het binnenmembraan van de cel en stak uit in het binnenste van de cel, waar het in direct contact kwam met PopZ.
"De exacte oriëntatie van dit eiwitcomplex is de afgelopen 12 jaar gedebatteerd, " zei Saurabh. "We waren in staat om de eiwitpartners met een uitstekende resolutie te observeren. Nu hebben we een heel precies beeld van hoe deze eiwitten in de cel met elkaar praten."
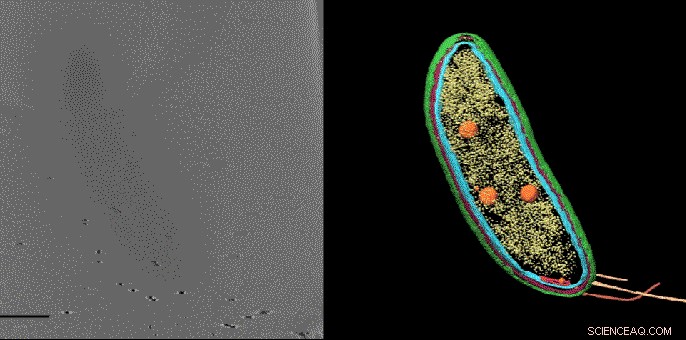
Met een techniek genaamd cryo-elektronentomografie, wetenschappers kunnen gedetailleerde 3D-beelden van cellen maken, zoals deze Caulobacter-bacterie, en markeer hun componenten - in dit geval, de celmembranen (rood en blauw), eiwitschil (groen), eiwitfabrieken bekend als ribosomen (geel) en opslagkorrels (oranje). Maar tot nu toe, kleinere structuren en individuele moleculen konden niet worden geïdentificeerd en precies binnen deze afbeeldingen worden gelokaliseerd. Een nieuwe beeldvormingstechniek ontwikkeld aan Stanford vult deze leemte, waardoor kleine moleculen worden onthuld die hier niet zichtbaar zijn. Krediet:Peter Dahlberg et al., PNAS , 8 juni 2020
Het team testte de nauwkeurigheid van CIASM door het te gebruiken om de locatie te bevestigen van een eiwit genaamd McpA waarvan bekend was dat het deel uitmaakte van een chemoreceptorarray in de bacteriën. "Prachtig gevoelige eiwitten in deze reeks dienen als de neus van Caulobacter, "Saurabh zei, "de chemie van de omgeving voelen, zodat ze weg kunnen gaan van onaangename dingen en naar de glucose kunnen gaan die ze eten."
De array verschijnt als parallelle zwarte lijnen in CET-afbeeldingen, en fluorescerende tagging van dezelfde afbeeldingen lokaliseerde de locaties van individuele McpA-eiwitten binnen ongeveer 10 nanometer.
Een gedetailleerde blik op kwantumstippen
In een aparte, parallelle studie, gepubliceerd 24 april in Angewandte Chemie , de onderzoekers gebruikten een vergelijkbare techniek om naar enkele kwantumstippen te kijken, met enkele verrassende resultaten.
Quantum dots zijn kristallen van halfgeleidermateriaal op nanoschaal die van nature fluoresceren in kleuren die worden bepaald door hun grootte, vorm en compositie. Deze stippen worden gebruikt in onderzoek om eiwitten en andere biologische materialen te labelen en te volgen, en potentiële toepassingen hebben in toekomstige elektronica, verlichting, kwantumcomputers, medische beeldvorming en andere gebieden.
In dit onderzoek, het doel was om te zien hoe de fijnere structurele details van individuele punten gerelateerd waren aan specifieke details van hun optische eigenschappen, zei Davis Perez, een doctoraat student in het laboratorium van Moerner.
"We waren in staat om enkele verrassende gedragingen van de individuele kwantumstippen te zien, bijvoorbeeld, in hun reactie op excitatie met laserlicht, " zei hij. "Maar het meest opwindende aspect voor mij is dat de methode die we hebben ontwikkeld om kwantumstippen te bestuderen, ook kan worden gebruikt om biologische systemen te bestuderen, zoals fotosynthetische eiwitten, waar energie wordt overgedragen tussen groepen eiwitten, en zie hoe de fotosynthetische machine werkt."
Moerner zei dat zijn laboratorium met Chiu samenwerkt om deze uitdagingen aan te gaan.
"Het zijn de begindagen van het combineren van de twee methoden, en we zijn verheugd om meer samenwerkingen te onderzoeken die licht en elektronen met elkaar verbinden, " zei Chiu. "Deze hybride beeldvormingsbenadering heeft het potentieel om structuren van moleculaire componenten bloot te leggen die betrokken zijn bij belangrijke biologische processen in cellen die alle domeinen van het leven overspannen."
 Inzicht in de omslagpunten van klimaatverandering uit het verleden kan ons helpen ons voor te bereiden op de toekomst
Inzicht in de omslagpunten van klimaatverandering uit het verleden kan ons helpen ons voor te bereiden op de toekomst Hoe snel kunnen bosbranden zich verspreiden?
Hoe snel kunnen bosbranden zich verspreiden?  Onderzoekers onderzoeken microplastics in drinkwater
Onderzoekers onderzoeken microplastics in drinkwater Onderzoekers onderzoeken hoe verschuivingen in federale benaderingen het tij van destructieve bosbranden kunnen keren
Onderzoekers onderzoeken hoe verschuivingen in federale benaderingen het tij van destructieve bosbranden kunnen keren Optimalisatie van recycling van autowrakken levert grote besparingen op
Optimalisatie van recycling van autowrakken levert grote besparingen op
Hoofdlijnen
- Je lichaamscellen gebruiken en verzetten zich tegen kracht, en ze bewegen. Zijn mechanobiologie
- Beren hebben geen last van een dieet met veel verzadigde vetten
- Wat is het verschil in de cellen van een menselijke baby en een volwassen mens?
Nieuwe baby's zijn allebei erg op elkaar en lijken erg op volwassenen. De meeste celontwikkeling en -differentiatie vinden plaats voorafgaand aan de geboorte van een ba
- Kunnen condors terugkeren naar Noord-Californië?
- Hoe te differentiëren tussen mitose en cytokinese
- Vijf soorten ecologische relaties
- Hoeveel calorieën verbrand ik als ik lach?
- Hoe de bacteriegroei in petrischalen te meten
- Acht jaar durend onderzoek levert een verhandeling op over lintwormen en honderden nieuwe soorten
- Kanker gericht met herbruikbare brandnetelbehandeling

- Metalen organische kaders metalen meesterschap

- Een nieuwe fluorescerende sonde die B-cellen van T-cellen kan onderscheiden

- Studie biedt nieuwe aanwijzingen voor het verbeteren van chemotherapie
- Oostenrijkse onderzoekers vergemakkelijken de analyse van lipidegegevens
 Soorten zenuwen in het menselijk lichaam
Soorten zenuwen in het menselijk lichaam Rapport vindt verbeteringen in de algehele gezondheid van Chesapeake Bays
Rapport vindt verbeteringen in de algehele gezondheid van Chesapeake Bays Ounces converteren naar metric
Ounces converteren naar metric  Onderzoekers gaan koekoek over Antarctische pinguïnpoep
Onderzoekers gaan koekoek over Antarctische pinguïnpoep Onderdelentekort stopt productie Mercedes-Benz SUV in Alabama
Onderdelentekort stopt productie Mercedes-Benz SUV in Alabama Lineaire meters converteren naar lineaire voeten
Lineaire meters converteren naar lineaire voeten  Cell Analogy Project Ideas
Cell Analogy Project Ideas Wetenschapsproject: waarom zout dingen doet Float
Wetenschapsproject: waarom zout dingen doet Float
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

