
Wetenschap
Met zeep betrapt:begrijpen hoe zeepmoleculen eiwitten helpen om in en uit vorm te komen
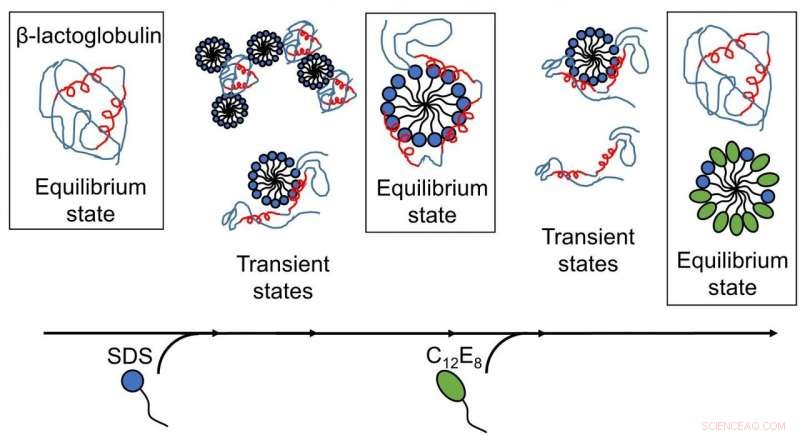
Resultaten gepubliceerd door AU-onderzoekers onthullen dat oppervlakteactieve stof-gemedieerde ontvouwing en hervouwing van eiwitten complexe processen zijn met verschillende aanwezige structuren, en herschikkingen vinden plaats op tijdschalen van submilliseconden tot minuten. (Afbeelding:gereproduceerd met toestemming van de Royal Society of Chemistry). Credit: Chem Sci , copyright 2020 Royal Society of Chemistry.
Het begrijpen van de interacties tussen eiwitten en zeepmoleculen (surfactants) is al lang belangrijk voor de industrie, vooral in wasmiddelen en cosmetica. Van de anionische oppervlakteactieve stof natriumdodecylsulfaat (SDS) is bekend dat het bolvormige eiwitten ontvouwt, terwijl de niet-ionische oppervlakteactieve stof octaethyleenglycolmonododecylether (C12E8) het tegenovergestelde doet, d.w.z. het helpt eiwitten weer in vorm te vouwen.
Om waspoeders efficiënt te laten werken, het is belangrijk dat de oppervlakteactieve stoffen de structuur van eiwitten (enzymen) niet veranderen, omdat elke verandering in de enzymstructuur hun vermogen om vlekken af te breken en vuil te verwijderen doodt. De meeste waspoeders bevatten mengsels van oppervlakteactieve stoffen waardoor de enzymen actief blijven. Ook, sommige biotechnologieën maken gebruik van oppervlakteactieve stoffen in combinatie met eiwitten.
Membraaneiwitten zitten meestal in het celmembraan. Om ze voor verschillende studies uit deze omgeving te halen, ze moeten worden opgelost door oppervlakteactieve stof. De oppervlakteactieve stof moet 'zacht' zijn en alleen het in het membraan ingebrachte deel van het eiwit bedekken, zodat de structuur behouden blijft. In tegenstelling tot, bij het karakteriseren van het molecuulgewicht van eiwitten in het laboratorium, een standaardtechniek is om ze te ontvouwen door de agressieve negatief geladen oppervlakteactieve stof, VIB, en volgen hoe ze migreren in een polymeergel in een elektrisch veld. Deze techniek werkt alleen als de oppervlakteactieve stof de eiwitten volledig ontvouwt en hun structuur vernietigt.
Er is nog steeds discussie over welk type interactie tussen het eiwit en de oppervlakteactieve stof het belangrijkst is. Zijn het de elektrostatische interacties tussen de ladingen van de oppervlakteactieve stof en het eiwit, of zijn het gewoon de eigenschappen van het grensvlak van de aggregaten (micellen) die de oppervlakteactieve stoffen in water vormen, welke zijn verantwoordelijk voor de ontvouwing van het eiwit?
Hoewel ontvouwen in detail is bestudeerd op eiwitniveau, een compleet beeld van de interactie tussen eiwit en surfactant ontbreekt bij deze processen. Dit gebrek aan kennis wordt aangepakt in het huidige werk met behulp van het globulaire eiwit β-lactoglobuline (bLG) als een modeleiwit.
De juiste combinatie van experimentele technieken
Er werd dieper inzicht verkregen in het ontvouwen en opnieuw vouwen van eiwitten, omdat de verschillende stappen van interacties tussen oppervlakteactieve stof en eiwitten in kaart werden gebracht als een functie van de tijd. Ten eerste, het modeleiwit, bLG, werd gemengd met de anionische oppervlakteactieve stof SDS terwijl de tijdsevolutie van de vorming van complexen tussen eiwit- en oppervlakteactieve stofmoleculen op de milliseconde-minuten tijdschaal werd gevolgd. Hiermee hebben de onderzoekers de structuur van de evoluerende complexen bepaald. Vervolgens brachten ze het tijdsverloop van het hervouwingsproces in kaart wanneer niet-geladen surfactant (C12E8) werd toegevoegd aan een monster dat complexen van SDS en eiwit bevatte.
Om te observeren hoe het eiwit zich herschikt tijdens het ontvouw- en hervouwingsproces geïnduceerd door oppervlakteactieve stoffen, complementaire spectroscopische technieken, circulair dichroïsme en tryptofaanfluorescentie, werden gebruikt in combinatie met time-resolved Small-angle X-ray scattering (SAXS).
Circulair dichroïsme en tryptofaanfluorescentie volgen veranderingen in de structuur van bLG, terwijl veranderingen in de algehele vorm van de eiwit-surfactantcomplexen werden gevolgd door synchrotron SAXS. Deze combinatie van technieken is nog niet eerder gebruikt om deze processen te bestuderen.
Complexe processen die milliseconden tot minuten duren
Het ontvouwen van het eiwit door SDS was een homogeen proces, waarbij alle eiwitmoleculen dezelfde ontvouwingsroute volgen. De SDS-complexen (micellen) vallen de eiwitmoleculen frontaal aan en ontvouwen het eiwit vervolgens geleidelijk zodat het een schil vormt rond de SDS-micel. Het hervouwen begint wanneer C12E8-micellen SDS uit het eiwit-SDS-complex "zuigen" om gemengde SDS-C12E8-micellen te vormen. Echter, het eigenlijke hervouwproces lijkt verschillende routes te volgen, omdat er meerdere structuren parallel bleken te vormen, namelijk eiwit-surfactant-complexen (waarschijnlijk zowel SDS als C12E8), gemengde micellen van SDS en C12E8, "naakte" eiwitten ontvouwden zich als lange polymere ketens, en correct gevouwen eiwitten. Door het experiment kon de onderlinge omzetting tussen deze soorten worden gevolgd, zodat kan worden bepaald welke van de processen snel zijn en welke langzaam. The folded protein could form both from the naked unfolded proteins (quickly) and from protein-surfactant complexes (more slowly). Dus, the best way in which surfactants can help a protein to fold is to basically get out of the way and let the protein find its own way back to the folded state.
The results have provided deeper insight into the structural changes occurring at the protein-surfactant level. They revealed that surfactant-mediated unfolding and refolding of proteins are complex processes of rearrangements occurring on time scales from below milliseconds to minutes and involve intimate collaboration between surfactant complexes and proteins.
 Een duurzaamheidsindicator om de fietsvriendelijkheid van Amerikaanse steden te vergelijken
Een duurzaamheidsindicator om de fietsvriendelijkheid van Amerikaanse steden te vergelijken Waterstof is een van de toekomstige bestuurders van stookolie en milieuactivisten kunnen beide steunen
Waterstof is een van de toekomstige bestuurders van stookolie en milieuactivisten kunnen beide steunen Luchtwegaandoeningen nemen toe in Brazilië terwijl Amazon-branden woeden
Luchtwegaandoeningen nemen toe in Brazilië terwijl Amazon-branden woeden Hoe het de Groenlandse ijskap verging in 2018
Hoe het de Groenlandse ijskap verging in 2018 Ongebruikelijke slijmachtige substantie gevonden begraven in zeebodemsediment
Ongebruikelijke slijmachtige substantie gevonden begraven in zeebodemsediment
Hoofdlijnen
- Wat zijn de 4 kenmerken die biologen gebruiken om levende dingen te herkennen?
- Welke oorzaken smeren bij elektroforese?
- Wat gebeurt er met de nucleaire envelop tijdens cytokinese?
Cytokinese is de verdeling van één cel in twee en is de laatste stap na de mitotische celcyclus in vier stadia. Tijdens cytokinese blijft de nucleaire envelop, of kernmembraan, die het gen
- Hoe neemt een slijmvorm beslissingen zonder hersenen?
- Nieuwe statistische methode voor het evalueren van reproduceerbaarheid in studies van genoomorganisatie
- Bang voor spinnen? Het kan in je DNA zitten
- Mutualisme (biologie): definitie, types, feiten en voorbeelden
- Interferentie berekenen
- Theory of Evolution: Definition, Charles Darwin, Evidence & Voorbeelden
- Met suiker bedekte wereld

- Selectieve fotothermische therapie met supramoleculaire radicale anionen die in situ worden gegenereerd
- Nauwkeurige medicijndoseringen met protonvallen

- Onderzoekers gebruiken zijde van zijderupsen om spierweefsel te modelleren

- Speciale eiwitrijke planten zorgen voor eiwitten, vezels en antioxidanten in één verpakking

 Hangry voelen is normaal en je kunt je hersenen de schuld geven
Hangry voelen is normaal en je kunt je hersenen de schuld geven  Weer een kortzichtige aanval op de planning?
Weer een kortzichtige aanval op de planning? MUSE onthult een gloeiende lichtring in het verre heelal
MUSE onthult een gloeiende lichtring in het verre heelal Natuurkundigen meten voor het eerst de variatie van de top-quarkmassa
Natuurkundigen meten voor het eerst de variatie van de top-quarkmassa Dieetrichtlijnen zijn een win-win-win voor voeding, milieu en dieren
Dieetrichtlijnen zijn een win-win-win voor voeding, milieu en dieren Onderzoekers onderzoeken achteruitgang van Zuid-Afrikaanse bosvogels
Onderzoekers onderzoeken achteruitgang van Zuid-Afrikaanse bosvogels De effecten van zoutconcentratie op bacteriegroei
De effecten van zoutconcentratie op bacteriegroei Vertrek ontwerpleider draagt bij aan onzekerheid bij Apple
Vertrek ontwerpleider draagt bij aan onzekerheid bij Apple
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

