Wetenschap
Nanocontainers voor gerichte medicijnafgifte
Krediet:RUDN University
RUDN University bio-ingenieurs hebben magnetische nanocontainers gemaakt voor slimme levering van medicijnen aan de gewenste organen of weefsels, wat het risico op bijwerkingen vermindert. Een experiment op muizen wees uit dat de nanocontainers niet giftig zijn. De resultaten van het onderzoek zijn gepubliceerd in het tijdschrift polymeren .
Farmaceutische bijwerkingen treden vaak op omdat de werkzame stof van het medicijn in gezonde organen terechtkomt. Dat is waarom, bijvoorbeeld, chemotherapie is zo moeilijk voor patiënten bij de behandeling van kanker:toxische geneesmiddelen tasten niet alleen tumorcellen aan, maar het hele lichaam. Gerichte medicijnafgiftesystemen lossen dit probleem op. De afgelopen jaren zijn er veel potentiële dragers voorgesteld:microcapsules met een omhulsel van polyelektrolyten, kunstmatige liposomen op micro- en nanoschaal, en eiwit nanodeeltjes, bijvoorbeeld. Enkele tientallen medicijnen die in dergelijke containers zijn verpakt, worden al in de praktijk gebruikt of ondergaan klinische proeven.
Echter, er zijn nog veel problemen die het wijdverbreide gebruik van smart carriers in de weg staan. Een daarvan is dat de afhankelijkheid van het biodistributieproces van geneesmiddelen in weefsels de grootte van containers dicteert. Hoe kleiner de maat, hoe groter de kans dat het medicijn het juiste orgaan bereikt, en hoe lager de dosis van het medicijn nodig is, toxische effecten verminderen. Een ander probleem is het gebrek aan informatie over toxiciteit, effecten op het lichaam en de verspreiding in levende weefsels. Beide problemen zijn met succes opgelost door de biochemici van de RUDN University in samenwerking met collega's uit Rusland en het VK.
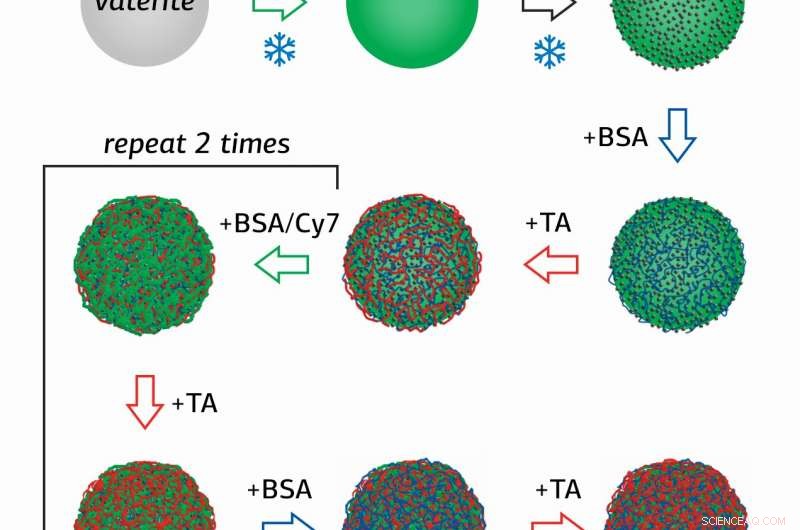
Onderzoeker van het Surface Engineering Laboratory van RUDN University Olga Sindeeva en haar co-auteurs creëerden magnetisch gevoelige containers op submicronschaal - deeltjes van 400-600 nanometer, met een omhulsel van verschillende lagen runderserumalbumine (BSA) met een fluorescerende tag Cy7, en looizuur (TA).
De nieuwigheid van de studie zit in de methode om containers te verkrijgen, waarin nanodeeltjes van magnetiet (MNP's), gemengd ijzeroxide (II, III) werden eerst geadsorbeerd op het oppervlak van poreuze korrels van calciumcarbonaat, die vervolgens achtereenvolgens werden gecoat met verschillende lagen BSA-Cy7 en TA. Vervolgens, Calciumcarbonaat werd uit de containers gewassen met behulp van een waterige oplossing met een chelaatvormer.
"Met deze methode het was mogelijk om de hoeveelheid magnetiet in containers te verdubbelen in vergelijking met wat wordt verkregen door adsorptie- en co-depositiemethoden. Dus, het is mogelijk om het magnetische moment van nanocontainers te vergroten en de snelheid van hun beweging in het vasculaire systeem te verhogen, " legde Olga Sindeeva uit.
Bio-ingenieurs van de RUDN University verwachten dat de submicrongrootte van de containers de biologische beschikbaarheid van het medicijn dat in de MNP's (BSA-Cy7-TA) container wordt geladen, zal verhogen.
Voorlopige experimenten op twee cellijnen, HeLa en fibroblasten, hebben aangetoond dat de containers de levensvatbaarheid van de cellen niet beïnvloeden en in vivo kunnen worden gebruikt.
De medicijnvrije containers werden vervolgens getest op levende BALB/c-muizen van beide geslachten met een gewicht van ongeveer 20 gram, 10 personen per groep. Houders in de vorm van een suspensie in zoutoplossing werden in de staartader van verdoofde muizen geïnjecteerd. Een suspensie van magnetietvrije containers (BSA-Cy7-TA) werd als controle gebruikt. Vervolgens, een van de achterpoten van de muizen werd een uur lang blootgesteld aan een magnetisch veld, terwijl de andere ter vergelijking vrij werd gelaten. De verdeling van nanocontainers in de weefsels van levende muizen werd waargenomen met behulp van magnetische resonantie beeldvorming (MRI) en fluorescerende tomografie. Magnetometrische analyse en histologisch onderzoek van postmortale muizenweefsels werden ook één uur na verwijdering van de magneet uitgevoerd.
RUDN University-biologen hebben aangetoond dat in de perifere vaten van de achterpoten in rust bij een lage bloedstroomsnelheid, MNP's (BSA-Cy7-TA) deeltjes bewegen in het eerste uur na intraveneuze injectie in de richting van het ledemaat waaraan de magneet is bevestigd.
MRI toonde aan dat de concentratie magnetiet in de spier bij de magneet door het maximum gaat. De hoeveelheid magnetiet bleek 70 procent hoger te zijn dan in de vrije ledemaat. Vervolgens, het magnetietsignaal zakte naar achtergrondwaarden.
Volgens de resultaten van histologische studies en magnetometrie, de onderzoekers ontdekten dat MNP's (BSA-Cy7-TA) zich voornamelijk in de longen concentreerden, en, in mindere mate, in de lever en milt. Bovendien, hun concentratie in de longen was vier tot vijf keer hoger. Een kleine hoeveelheid van de drager werd ook gevonden in andere inwendige organen en spieren, maar de concentratie was significant lager dan in de longen. Dus, biochemici concludeerden dat de distributie van intraveneuze containers afhangt van de bloedtoevoer naar de organen, dat is, op de snelheid van de bloedstroom, maar is gevoelig voor de lokalisatie van het magnetische veld.
Bijzondere aandacht werd besteed aan de toxiciteit van intraveneuze containers en hun effecten op het lichaam. Voorlopige tests hebben aangetoond dat in vitro in plasma of bloed, een aanzienlijk percentage van de containers wordt in de loop van een dag vernietigd. De resultaten van de onderzoeken suggereren dat de containers tijd hebben om het doel te bereiken met intraveneuze injectie. Vervolgens, door het fluorescentiesignaal te veranderen, de dragerdeeltjes worden geleidelijk afgebroken en uit het lichaam uitgescheiden.
De deeltjes zijn niet giftig en hemocompatibel, en door hun grootte kunnen ze weefsels van het lichaam binnendringen, maar in werkdoses, ze zijn niet schadelijk voor de luchtwegen of de bloedsomloop, en hebben geen invloed op de nier- of leverfuncties. De activering van het complementsysteem dat nodig is voor de biologische afbraak van het eiwitmembraan van de containers heeft geen invloed op het niveau van leukocyten, en leidt daarom niet tot een merkbare systematische ontsteking.
Dus, de onderzoekers van de RUDN University waren in staat om containers met een hoge hoeveelheid magnetiet in het lichaam te engineeren en te distribueren, en hun inzet effectief te beheren met behulp van een magnetisch veld.
In de toekomst, de projectdeelnemers zijn van plan om slimme nanocapsules te maken die het medicijn in het juiste orgaan kunnen afleveren en openen om de werkzame stof vrij te maken. Deze methode van medicijnafgifte zou de bijwerkingen van de behandeling vermijden. Patiënten met een scala aan ziekten, inclusief kinderen of ouderen met een slechte gezondheid, kunnen worden behandeld met medicijnen die anders vermeden zouden kunnen worden vanwege bijwerkingen die de toestand van de patiënt verergeren.
 Een onzichtbaar sleutelgat via transparante elektronica
Een onzichtbaar sleutelgat via transparante elektronica Wetenschappers ontrafelen de mysteries van onomkeerbaarheid in elektrochrome dunne films
Wetenschappers ontrafelen de mysteries van onomkeerbaarheid in elektrochrome dunne films Grote vooruitgang in detectie van nanoporiën van peptiden en eiwitten
Grote vooruitgang in detectie van nanoporiën van peptiden en eiwitten Wat is het verschil in graad tussen Celsius versus Fahrenheit?
Wat is het verschil in graad tussen Celsius versus Fahrenheit?  De mechanismen van verbeterde verdampingsflux door nanokanalen
De mechanismen van verbeterde verdampingsflux door nanokanalen
 Theorie van niet-orthogonalisatie en ruimtelijke lokalisatie voor convectie-toelatende ensemble-voorspelling
Theorie van niet-orthogonalisatie en ruimtelijke lokalisatie voor convectie-toelatende ensemble-voorspelling De offshore-olieplatforms van Californië zijn tientallen jaren oud, en de industrie verzet zich tegen de ontmanteling ervan
De offshore-olieplatforms van Californië zijn tientallen jaren oud, en de industrie verzet zich tegen de ontmanteling ervan Het plasticprobleem in de oceanen is dichter bij huis dan wetenschappers eerst dachten
Het plasticprobleem in de oceanen is dichter bij huis dan wetenschappers eerst dachten Plantetende dieren in het regenwoud
Plantetende dieren in het regenwoud Loodvervuiling door indianen toegeschreven aan verpletterende galena voor glitterverf
Loodvervuiling door indianen toegeschreven aan verpletterende galena voor glitterverf
Hoofdlijnen
- De verbazingwekkende diversiteit – en mogelijk verval – van paddenstoelen en andere schimmels
- Human Heart Science Projects
- Dolfijnen slaan mensen, chimpansees bij vroege tekenen van zelfbewustzijn
- Het belang van asymmetrie bij bacteriën
- Hoe geslachtsaanpassende chirurgie werkt
- Ecosysteem: definitie, types, structuur en voorbeelden
- De wereldwijde impact van krimpende gletsjers op ongewervelde rivieren in kaart brengen
- Met extra suiker, bladeren worden ook dik
- Het hormoon dat uw hond agressief zou kunnen maken
 Het verschil tussen een Black Snake & een Racer
Het verschil tussen een Black Snake & een Racer  Een thermometer maken voor kinderen
Een thermometer maken voor kinderen Wetenschappelijke synergie tussen NASA en de U.S. Geological Survey
Wetenschappelijke synergie tussen NASA en de U.S. Geological Survey De recyclingcrisis in Australië:gemakkelijke oplossingen voor een moeilijk probleem
De recyclingcrisis in Australië:gemakkelijke oplossingen voor een moeilijk probleem Ideeën over Rainbow Science Fair-projecten
Ideeën over Rainbow Science Fair-projecten  Pas ontdekte Martiaanse aurora eigenlijk de meest voorkomende; werpt licht op het veranderende klimaat van Mars
Pas ontdekte Martiaanse aurora eigenlijk de meest voorkomende; werpt licht op het veranderende klimaat van Mars Superzware zwarte gaten gevonden in twee kleine sterrenstelsels
Superzware zwarte gaten gevonden in twee kleine sterrenstelsels Niet-lineaire optica ontmoet röntgenstraling
Niet-lineaire optica ontmoet röntgenstraling
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com