
Wetenschap
Zelfherstellende vloeistof brengt nieuw leven in batterijalternatief
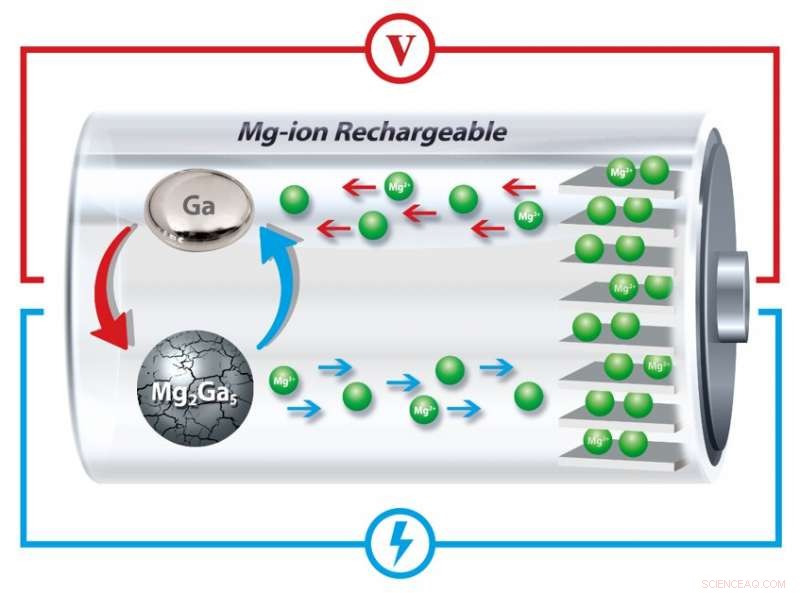
In het nieuwe anodeontwerp van de onderzoekers, gallium smelt herhaaldelijk en stolt, het "genezen" van de scheuren die anders geleidelijk het vermogen van de batterij om een lading vast te houden zouden verminderen. Krediet:Universiteit van Pennsylvania
Oplaadbare lithium-ion (Li-ion) batterijen zijn een revolutionaire technologie, gevonden in alles, van mobiele telefoons tot auto's. Hun alomtegenwoordigheid en rol bij het doorbreken van de afhankelijkheid van fossiele brandstoffen leverde dit jaar een drietal onderzoekers de Nobelprijs voor de Scheikunde op.
Maar zelfs nu Li-ion-batterijtechnologie wordt erkend met een van de hoofdprijzen van de wetenschap, de chemie achter hen staat voor een dreigende uitdaging. Lithium-ionbatterijen kunnen niet oneindig worden opgeladen; de materialen in de elektroden van deze batterijen zetten uit en barsten bij elke cyclus, hun opslagprestaties geleidelijk verminderen totdat ze nutteloos zijn. De resulterende vraag naar vers lithium, kobalt en andere noodzakelijke elementen belasten de natuurlijke hulpbronnen.
Met deze uitdaging in het achterhoofd, Penn Engineers zijn op zoek naar oplaadbare batterij-elektroden die efficiënt kunnen werken met andere metaalionen dan lithium. Magnesium-ionbatterijen zijn een veelbelovend alternatief, maar materialen die magnesium omkeerbaar kunnen opslaan, zijn tot dusverre nog gevoeliger geweest voor het kraken en andere problemen dan hun Li-ion-neven.
De Penn-onderzoekers hebben nu een oplossing gevonden door gallium op te nemen, een metaal met een smeltpunt dat enkele graden hoger ligt dan kamertemperatuur, in de anode van een magnesium-ionbatterij. Door te smelten en te stollen bij elke laad- en ontlaadcyclus, deze anoden kunnen het barsten en de daaropvolgende expansie "genezen" die normaal gesproken de opslag van oplaadbare batterijen verslechteren.
Hun experimenten tonen aan dat deze nieuwe anode de levensduur van magnesium-ionbatterijen aanzienlijk verlengt, en doet dit zonder de noodzaak van dure materialen op nanoschaal. Deze eigenschappen kunnen magnesium-ionbatterijen geschikt maken voor grootschalige toepassingen, de lithiumbronnen onder druk zetten.
De onderzoekers demonstreerden hun op gallium gebaseerde anode in een studie gepubliceerd in Geavanceerde energiematerialen .
Het onderzoek werd geleid door Eric Detsi, Stephenson Term Assistant Professor bij de afdeling Materials Science and Engineering, samen met Lin Wang en Samuel Welborn, afgestudeerde studenten in zijn lab. Ze werkten samen met Vivek Shenoy, Eduardo D. Glandt President's Distinguished Professor bij de afdeling Materials Science and Engineering.
"Voor de meeste elektrische voertuigen het gewicht van de batterij vertegenwoordigt ongeveer een vijfde van het totale gewicht van het voertuig. Door uitsluitend te vertrouwen op lithium-ionbatterijen om deze voertuigen over de hele wereld van stroom te voorzien, zullen de lithium- en kobaltbronnen die in de batterijen worden gebruikt, aanzienlijk worden belast. zegt Detsi. "Ze worden nu al duurder door de vraag, en de wereldwijde kobaltmarkt is sterk afhankelijk van leveringen uit landen met hoge geopolitieke risico's."
"Het is duidelijk dat er alternatieve batterijtechnologieën nodig zijn, "zegt hij. "Niet om lithium te vervangen, maar om lithium te ondersteunen."
Het laden en ontladen van een batterij gaat gepaard met chemische reacties waardoor ionen van de ene elektrode van de batterij naar de andere kunnen gaan, het verkrijgen of vrijgeven van elektronen in het proces. Echter, iedereen met een verouderde mobiele telefoon of laptop weet dat deze batterijen na verloop van tijd hun vermogen verliezen om hun lading vast te houden. Een van de belangrijkste redenen waarom deze batterijen niet werken, is dat de laad- en ontlaadcyclus een fysieke transformatie van de materialen in de elektroden met zich meebrengt. Wanneer ionen in de elektrode worden opgenomen, die materialen breiden uit, en wanneer de ionen vrijkomen uit de elektrode, de materialen barsten. Dit proces gaat door totdat de materialen breken en fysiek het elektrisch contact met de elektroden verliezen, waardoor de batterij onbruikbaar wordt.
"De volumeverandering die optreedt in de meeste elektrodematerialen als gevolg van opname en afgifte van ionen leidt tot barsten en verpulvering. Het is een van de dingen die een batterij doden, " zegt Wang. "Deze verpulvering wordt geassocieerd met de spanningsopbouw die gepaard gaat met een solide-vaste fasetransformatie."
"In ons nieuwe werk echter, "Welborn zegt, "in plaats van een transformatie van het ene type vaste stof naar het andere, het oorspronkelijke vaste materiaal verandert in een vloeistof. Dit remt het kraken en verpulveren omdat de spanningen die gepaard gaan met de normale vast-vast-transformatie niet langer aanwezig zijn."
Op kamertemperatuur, puur gallium is een kneedbaar, zilverachtig metaal dat gemakkelijk kan worden aangezien voor aluminium of nikkel. Houd wat in je hand, echter, onthult snel een unieke eigenschap:met een smeltpunt van 85 graden Fahrenheit, lichaamstemperatuur is voldoende om een vast stuk gallium in een kwikachtige vloeistof te veranderen.
In de nieuwe studie van de onderzoekers, het gallium begint in een vaste vorm omdat het is gelegeerd met magnesium in deeltjes van microngrootte.
"Om deze kleine stukjes elektronisch met elkaar te verbinden, "Wan zegt, "We plaatsen ze in een geleidend netwerk van koolstofvezels, carbon black en grafeen die allemaal aan elkaar zijn gebonden met een bindmiddel."
Wanneer de magnesiumionen scheiden van het gallium, het verandert in zijn vloeibare toestand omdat de batterij werkt bij temperaturen die iets boven het smeltpunt van gallium liggen.
"Omdat het is gebundeld in dit netwerk van andere materialen, "Welborn zegt, "wanneer het gallium van vast naar vloeibaar gaat, het beweegt niet zoals je zou verwachten van een vloeistof."
Met behulp van röntgenstralen om de kristalstructuur van de materialen in de batterij te onderzoeken, toonden de onderzoekers aan dat wanneer de batterij wordt opgeladen, ionen keren terug naar de anode en vormen opnieuw vaste gallium-magnesiumdeeltjes.
Kritisch, aangezien deze deeltjes met elke cyclus worden gereconstitueerd, ze ervaren niet het soort barsten dat uiteindelijk andere batterijen aantast.
De experimentele batterij van de onderzoekers doorstond meer dan duizend oplaadcycli, ongeveer vijf keer meer dan de huidige state-of-the-art magnesium-ion batterij.
"De duizend cycli die in dit werk worden aangetoond, vertegenwoordigen een aanzienlijke verbetering, "Detsi zegt, "maar onze droom is om te profiteren van dit unieke zelfgenezende gedrag om een batterij te ontwerpen die voor altijd kan worden opgeladen en ontladen."
De limiet op de levensduur van duizend cycli van de nieuwe batterij is niet te wijten aan de elektrode, maar eerder de elektrolyt, het vloeibare medium dat ionen van de ene elektrode naar de andere verplaatst. Eerder onderzoek van Detsi's groep heeft de rol aangetoond die de elektrolyt speelt bij het langzaam afbreken van de batterij-elektroden, en toekomstig werk zal zich richten op hoe dat proces te verbeteren.
Gelukkig, zoals bij het ontwerp van de zelfherstellende elektroden van het onderzoek, werken aan dit aspect van batterijontwerp omvat slimme toepassingen van chemie, in plaats van dure nanotechnologietechnieken zijn er andere pogingen om de levensduur van de batterij te verlengen.
"Om de problemen met lithium-ionbatterijen op te lossen, de batterijgemeenschap maakt vaak gebruik van nanomaterialen, " zegt Detsi. "Echter, de synthese van nanomaterialen kan complex zijn, wat betekent dat het maken van tonnen nanomaterialen op industriële schaal voor batterijtoepassingen erg duur kan zijn. Wat opvalt aan ons ontwerp is dat er geen nanomaterialen nodig zijn, wat deze klasse batterijen zeer aantrekkelijk maakt voor grootschalige toepassingen."
 Nieuwe studie onthult de kracht van de diepe oceaancirculatie in de Zuid-Atlantische Oceaan
Nieuwe studie onthult de kracht van de diepe oceaancirculatie in de Zuid-Atlantische Oceaan Bangladesh heeft duizenden levens gered van een verwoestende cycloon - dit is hoe
Bangladesh heeft duizenden levens gered van een verwoestende cycloon - dit is hoe The Differences Between Stingrays & Skates
The Differences Between Stingrays & Skates Snelle verkenning na de aardbeving van Anchorage in 2018 onthult tekenen van grondfalen
Snelle verkenning na de aardbeving van Anchorage in 2018 onthult tekenen van grondfalen Dodelijke hittegolven kunnen deze eeuw Zuid-Azië treffen:studie
Dodelijke hittegolven kunnen deze eeuw Zuid-Azië treffen:studie
Hoofdlijnen
- Welke mechanismen zorgen voor de nauwkeurigheid van DNA-replicatie?
- Welke drie dingen helpen bloed door aderen te duwen?
- Stamcelplatform werpt nieuw licht op het begin van menselijke ontwikkeling
- Hoe een iconische foto van een appel de inspiratie vormde voor een verbeterde celanalyse
- Mysterieuze nieuwe DNA-structuur gevonden in levende menselijke cellen
- Voorbeelden van stoffen die gefaciliteerde diffusie gebruiken
- Wat gebruiken chloroplasten om glucose te maken?
- Staan we aan het begin van het einde van de westerse beschaving?
- Mariene wetenschappers leiden een uitgebreide beoordeling van soorten reuzenschelpdieren wereldwijd
- Wetenschappers ontwikkelen elastische metalen staven om scoliose te behandelen

- Chemici ontwerpen mini-ecosystemen om de werking van medicijnen te testen

- Experimentele natuurkundigen bestuderen staal aan boord van het ISS

- Wetenschappers laten zien hoe ze een katalysator kunnen beheersen die een broeikasgas in een brandstof of grondstof verandert
- Onderzoekers doen nieuwe ontdekking van mechanisme voor ladingopslag

 Eén stap naar efficiëntie van zonnecellen:chemisch proces van onderzoekers kan de productie verbeteren
Eén stap naar efficiëntie van zonnecellen:chemisch proces van onderzoekers kan de productie verbeteren De wet van Newton breken:intrigerende oscillerende heen-en-weer beweging van een kwantumdeeltje
De wet van Newton breken:intrigerende oscillerende heen-en-weer beweging van een kwantumdeeltje Nieuw model voorspelt een toename van stofstormen in de VS
Nieuw model voorspelt een toename van stofstormen in de VS Ozonvervuiling in Duitsland daalt dankzij lagere uitstoot van stikstofoxide
Ozonvervuiling in Duitsland daalt dankzij lagere uitstoot van stikstofoxide Het verminderen van vliegtuigemissies een verheven doel, maar vooruitgang ongrijpbaar
Het verminderen van vliegtuigemissies een verheven doel, maar vooruitgang ongrijpbaar Welke klassen moet je volgen op de middelbare school als je een chemisch ingenieur wilt worden?
Welke klassen moet je volgen op de middelbare school als je een chemisch ingenieur wilt worden?  Inwoners van Big Island worstelen een jaar na historische uitbarsting
Inwoners van Big Island worstelen een jaar na historische uitbarsting Omhulsel van nanodeeltjes levert een chemische stof die de opbouw van vet in de slagaders van knaagdieren stopt
Omhulsel van nanodeeltjes levert een chemische stof die de opbouw van vet in de slagaders van knaagdieren stopt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

