
Wetenschap
Wetenschappers ontdekken bindend geheim achter eiwitsuperlijm
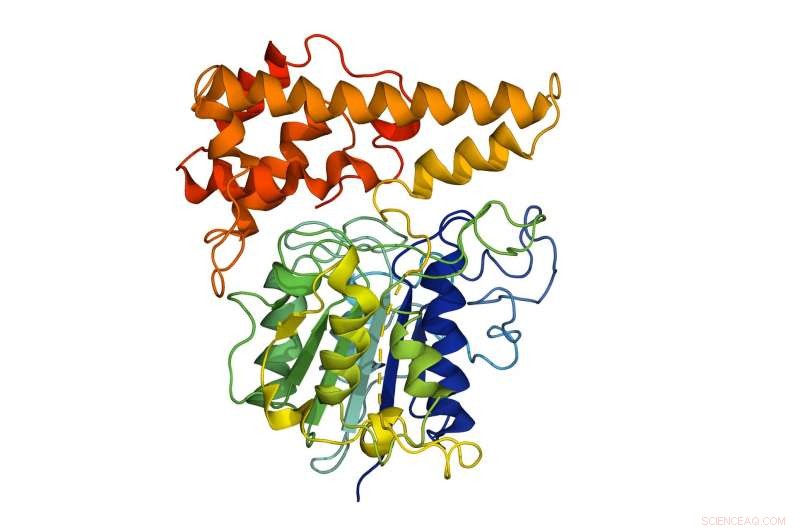
De moleculaire structuur van het peptide-ligase geëxtraheerd uit het Chinese viooltje (Viola yedoensis), waarvan het in het laboratorium gekweekte recombinante peptide-ligase was afgeleid. Dit in het laboratorium gekweekte peptide kan helpen bij de ontwikkeling van medicijnen die zijn gemaakt van componenten uit levende organismen, omdat het de beperkingen van de huidige methoden overwint, zoals bijproducten of toxische moleculen die de functie en werkzaamheid van een geneesmiddel kunnen veranderen. Krediet:Nanyang Technological University
Wetenschappers van de Nanyang Technological University, Singapore (NTU Singapore) hebben vastgesteld hoe een speciale klasse van plantaardige enzymen, bekend als peptide-ligasen, werken om eiwitten samen te voegen. Een dergelijke binding is een belangrijk proces bij de ontwikkeling van geneesmiddelen, bijvoorbeeld bij het specifiek hechten van een chemotherapiemedicijn aan een antilichaam dat tumormarkers herkent om kankercellen te targeten.
Breder, peptide-ligasen zijn een nuttig hulpmiddel in biotechnologische en biomedische toepassingen zoals eiwitlabeling, beeldvorming en het volgen van eiwitten in het lichaam.
De wetenschappers van NTU Singapore hebben aangetoond dat het geheim van de 'superlijm'-eigenschap van een peptide-ligase ligt in twee specifieke gebieden van het enzym die het het vermogen geven om zich aan andere moleculen te hechten, en om de snelheid waarmee het werkt te wijzigen.
Het NTU-team onder leiding van universitair hoofddocent Julien Lescar en professor James Tam van de NTU School of Biological Sciences gebruikten hun nieuw gevonden kennis om een nieuwe in het laboratorium gecreëerde peptide-ligase te ontwikkelen op basis van genetische informatie van het Chinese viooltje ( Altviool yedoensis ), een medicinale plant met antibiotische en ontstekingsremmende eigenschappen.
Het kunstmatig gecreëerde peptide-ligase, ook bekend als een recombinant peptide ligase, kan helpen bij de ontwikkeling van medicijnen die zijn gemaakt van componenten uit levende organismen, omdat het de beperkingen van de huidige methoden overwint, zoals bijproducten of toxische moleculen die de functie en werkzaamheid van een geneesmiddel kunnen veranderen.
De bevindingen werden in april gepubliceerd in de Proceedings van de National Academy of Sciences ( PNAS ).
Universitair hoofddocent Julien Lescar, die ook is gevestigd in het NTU Institute of Structural Biology (NISB), zei, "We hebben gebruikt wat we in de natuur hebben geleerd om een recombinant enzym in het laboratorium te ontwikkelen. Het hecht zich aan een specifiek eiwit, die vervolgens samenkomt met een ander specifiek eiwit of molecuul. Deze nieuwe manier van werken zou de basis kunnen vormen voor betere diagnostische tests of geneesmiddelen tegen kanker."
Momenteel, tijdens de ontwikkeling van medicijnen, eiwitmoleculen zijn chemisch aan elkaar gestikt. Hoewel dit efficiënt is, het proces laat bijproducten achter die de functie van het eindproduct kunnen veranderen.
Van planten afgeleide peptide-ligasen hebben bewezen een betrouwbaardere eiwit 'superlijm' te zijn dan ligasen die zijn afgeleid van bacteriën, of het gebruik van chemicaliën om eiwitten aan elkaar te binden. Assoc Prof Lescar merkte op dat door planten geëxtraheerde enzymen sporenverontreinigingen kunnen dragen die op hun beurt allergieën kunnen veroorzaken, en de beschikbaarheid van het enzym is afhankelijk van succesvol groeien en oogsten. In tegenstelling tot, het nieuwe door NTU ontwikkelde recombinante enzym kan in grote hoeveelheden zonder bijproducten in laboratoria worden geproduceerd.
Professor James Tam, die ook in het NISB zit, zei, "In heel eenvoudige bewoordingen, ons werk om deze ligasen te creëren, biedt een verbeterd platform voor nauwkeurige bioproductie van geneesmiddelen, diagnostiek en biomaterialen."
Een blad uit het natuurboek halen

(L-R) Dr. Hemu Xinya en Dr. Abbas El Sahili, NTU-onderzoekers van de School of Biological Sciences, maken deel uit van het NTU-team dat de in het laboratorium gekweekte recombinante peptide-ligase heeft gemaakt. Met behulp van de afgebeelde machine, ze hebben ontdekt dat het door NTU gecreëerde recombinante enzym 3 is, 000 keer efficiënter dan drie andere bekende soorten ligasen. Krediet:Nanyang Technological University
Het NTU-team bestudeerde de genetische informatie van enzymen die zijn geëxtraheerd uit het Chinese viooltje ( Altviool yedoensis ) en het Canadese viooltje ( Viola canadensis ). In plaats van de efficiëntie van deze geëxtraheerde enzymen te testen, de wetenschappers ontwikkelden vijf recombinante enzymmonsters door de genen van de enzymen in een insectencelcultuur te plaatsen. Van de vijf monsters drie zijn peptide-ligasen. De andere twee zijn proteasen, dat zijn enzymen die eiwitmoleculen in kleinere peptideketens splitsen.
De wetenschappers ontdekten dat een van de recombinante peptide-ligasemonsters, VyPAL2, heeft uitzonderlijke bindende eigenschappen, en is 3, 000 keer efficiënter dan drie andere bekende soorten ligasen.
Door een structurele analyse van VyPAL2, het NTU-team beperkte vervolgens de "controlecentra" van zijn superlijm-eigenschap tot twee specifieke regio's, die ze LAD1 en LAD2 noemden. LAD1 beïnvloedt de snelheid van enzymatische activiteit, terwijl LAD2 bepaalt of het enzym ligase- of protease-activiteit vertoont.
Proteasen omzetten in peptide-ligasen
Another discovery stemming from the knowledge of the peptide ligase's molecular mechanism is a method to convert it from being a cutter (a protease) into a joiner (peptide ligase). This can be done by introducing mutations into the LAD1 and LAD2 regions of a protease.
Knowing this conversion process opens up possibilities for identifying novel interesting peptide ligases by simply trawling through protein sequence databases, said Assoc Prof Lescar.
"When you have tens of thousands of proteases, and only a few known peptide ligases, trawling through the sequence databases with the LAD1 and LAD2 regions as the search criteria could lead to the discovery of more proteases that can be converted into peptide ligases. It's like a fishing expedition, but at least now we know where to fish."
Toekomstige toepassingen
The team recently received funding from NTUitive, NTU's innovation and enterprise company, and is now working to develop the recombinant enzyme into a product. The product will be eventually sold at Epitoire, a start-up founded by Assoc Prof Lescar. The start-up sells DNA, RNA and protein reagents for academics and researchers who wish to do protein modification.
The team is also partnering both local and overseas medical schools and health institutions to use this recombinant enzyme in diagnostic imaging, such as brain tumor imaging during a surgery.
A patent has been filed for the creation of the recombinant enzyme, as well as the mechanism that converts a protease into a ligase.
 Verschil tussen mannelijke en vrouwelijke sprinkhanen
Verschil tussen mannelijke en vrouwelijke sprinkhanen  Wanneer heter en droger meer betekent, maar uiteindelijk minder, bosbranden
Wanneer heter en droger meer betekent, maar uiteindelijk minder, bosbranden Tibetaans plateau zal sneller opwarmen dan verwacht
Tibetaans plateau zal sneller opwarmen dan verwacht Grote delen van het Braziliaanse regenwoud dreigen hun bescherming te verliezen
Grote delen van het Braziliaanse regenwoud dreigen hun bescherming te verliezen Nieuwe tool voor het beoordelen van de voordelen, risico's en duurzaamheid van de visconsumptie
Nieuwe tool voor het beoordelen van de voordelen, risico's en duurzaamheid van de visconsumptie
Hoofdlijnen
- Onderzoekers identificeren moleculaire motor die chromosomen transformeert
- Neurale opnames van wilde vleermuizen onthullen een unieke organisatie van het middenhersenengebied voor het volgen en vangen van prooien
- Wat is een molecuul dat wordt geproduceerd door DNA uit twee verschillende bronnen te combineren?
- Een nieuw wapen tegen malaria:wetenschappers hebben een nieuw doelwit ontdekt om de verantwoordelijke parasiet te blokkeren
- De snelheid van verval berekenen
- Welke elementen worden in levende organismen gevonden?
- Hoe gendoping werkt
- Peroxisomen: defintie, structuur en functie
- Het Mandela-effect:waarom we ons gebeurtenissen herinneren die niet hebben plaatsgevonden
- Zuurtolerant groen fluorescerend eiwit voor bio-imaging
- Peel-off coating houdt ontzilting schoner en groener
- Een katalysator voor duurzame methanol

- Brandstofcel zorgt voor een frisse wind voor toekomstig stroomalternatief

- Het vertragen van de rijping van druiven kan de kwaliteit van de bessen voor het maken van wijn verbeteren
 Eenvoudige regel voorspelt wanneer een ijstijd eindigt
Eenvoudige regel voorspelt wanneer een ijstijd eindigt Welke invloed hebben energiedranken op planten?
Welke invloed hebben energiedranken op planten?  Breidt water uit of krimpt het bij verhitting?
Breidt water uit of krimpt het bij verhitting?  Berekening van de noemer Vrijheidsgraden
Berekening van de noemer Vrijheidsgraden Afbeelding:een zeldzaam optisch fenomeen gezien vanuit een baan om de aarde
Afbeelding:een zeldzaam optisch fenomeen gezien vanuit een baan om de aarde De architecturen van binnenste mitochondriale membraaneiwitten begrijpen
De architecturen van binnenste mitochondriale membraaneiwitten begrijpen Overheden kunnen niet worden vertrouwd om welzijnsnormen voor kippen te leveren
Overheden kunnen niet worden vertrouwd om welzijnsnormen voor kippen te leveren Interferentie als nieuwe methode voor het koelen van kwantumapparaten
Interferentie als nieuwe methode voor het koelen van kwantumapparaten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

