
Wetenschap
Chemische synthese toont aan dat antibioticum uit de menselijke neus werkt door protontranslocatie
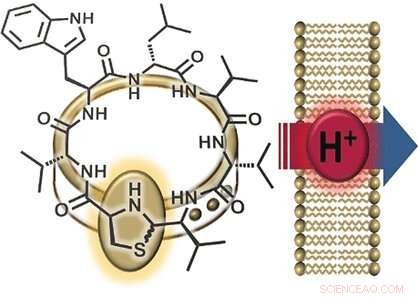
Krediet:Wiley
Antibioticaresistente bacteriën vormen een toenemende bedreiging voor de gezondheid, nieuwe antibiotica essentieel maken. Duitse onderzoekers hebben onlangs een doorbraak gehad:ze ontdekten lugdunine in de menselijke neus - een nieuw soort cyclisch peptide dat afkomstig is van de bacterie Staphylococcus lugdunensis en sterke antimicrobiële eigenschappen heeft tegen Stahphylococcus aureus, onder andere. De onderzoekers hebben het werkingsmechanisme kunnen verduidelijken door varianten te synthetiseren. Zoals ze uitleggen in het tijdschrift Angewandte Chemie , protontransport over bacteriële membranen is betrokken.
Een interessant onderdeel van de structuur van lugdunin is de thiazolidinegroep (een ring gemaakt van één stikstof, een zwavel, en drie koolstofatomen), die een deel van zijn peptidering vormt. Deze vijfledige ring lijkt op een gesp die de peptidering "versieert". Om deze reden, de onderzoekers noemden hun nieuwe klasse van materialen "fibupeptiden, " uit het Latijn kuitbeen , betekenis sluiting . Nadat we er eerder in waren geslaagd lugdunin te synthetiseren, het team van de Universiteit van Tübingen en de Universiteit van Göttingen (Duitsland) optimaliseerde de synthetische route om veel verschillende derivaten van deze natuurlijke stof te maken. Dit maakte een uitgebreide studie mogelijk van het mechanisme waarmee lugdunin werkt. De onderzoekers maakten een reeks derivaten waarin ze elk van de aminozuren in de peptidering vervingen door alanine - een waarin ze de "ornamentsluiting, " en een fibupeptide met een structuur die het spiegelbeeld is van lugdunin. Vervolgens gebruikten ze deze derivaten om activiteitstesten uit te voeren.
Het team, bestaande uit chemici, biochemici, en microbiologen, ontdekte dat de cyclische structuur van het peptide, de thiazolidine "sluiting, " en twee aminozuren (tryptofaan en leucine), zijn cruciaal voor de antibiotische activiteit van de verbinding. In aanvulling, de peptidering moet altijd uit afwisselende D- en L-aminozuren bestaan. Echter, er was geen verschil in de activiteit van het oorspronkelijke molecuul of zijn spiegelbeeld. "Dit duidt op een gebrek aan stereospecifieke receptor-ligand-interactie, " zegt Nadine Schilling, een lid van het team onder leiding van Stephanie Grond, "in plaats daarvan, het spreekt voor interactie met een klein molecuul of ion."
Een andere observatie was dat actieve lugduninederivaten de elektrische potentiaal (het verschil in spanning tussen de binnen- en buitenkant) van bacteriële celmembranen afbreken, waardoor de bacteriën worden gedood. Het opnemen van een extra tryptofaanmolecuul versterkte de interactie met het membraan en versterkte de antibacteriële werking. Grond zegt:"Deze resultaten suggereren ionentransport over het bacteriële membraan." Om deze functie nader te onderzoeken, de onderzoekers maakten synthetische blaasjes met een pH-gradiënt ten opzichte van de omringende oplossing. Toevoeging van actieve fibupeptiden leidde tot snelle pH-egalisatie, zonder vernietiging van het membraan of vorming van poriën. "Het mechanisme bestaat duidelijk uit translocatie van protonen over het membraan, ", zegt Grond. "We moeten nog bepalen of lugdunin als mobiel transportmiddel of als protonkanaal fungeert."
 Wetenschappers ontwikkelen een effectief systeem voor de levering van biomateriaal aan laboratoria
Wetenschappers ontwikkelen een effectief systeem voor de levering van biomateriaal aan laboratoria Berekening van de warmtecapaciteit
Berekening van de warmtecapaciteit DESYs-röntgenbron PETRA III onthult details van adhesieve structuren van spinnenpoten
DESYs-röntgenbron PETRA III onthult details van adhesieve structuren van spinnenpoten Hoe PPM & PPB
Hoe PPM & PPB Bonte bemanning:roest en licht een mogelijk antwoord op het raadsel van de productie van waterstofbrandstof
Bonte bemanning:roest en licht een mogelijk antwoord op het raadsel van de productie van waterstofbrandstof
 Wat is de samenstelling en temperatuur van de atmosfeer van de aarde?
Wat is de samenstelling en temperatuur van de atmosfeer van de aarde?  Door meer grote vissen in zee te laten, wordt de CO2-uitstoot verminderd
Door meer grote vissen in zee te laten, wordt de CO2-uitstoot verminderd Het meten van de klimaatimpact van bosbeheer - een baanbrekende aanpak
Het meten van de klimaatimpact van bosbeheer - een baanbrekende aanpak De fasen van mid-breedtegraad cycloons
De fasen van mid-breedtegraad cycloons  Onderzoek schetst de effecten van klimaatopwarming op microbiële netwerkinteracties
Onderzoek schetst de effecten van klimaatopwarming op microbiële netwerkinteracties
Hoofdlijnen
- Nieuwe slimme sensor om boeren te helpen kreupelheid bij schapen te herkennen
- Wat zijn de purine basen van DNA?
- Iteratieve evolutie:is de Aldabra-rail twee keer geëvolueerd?
- Zijn mannen of vrouwen gelukkiger?
- Deal verbiedt val in Colorado, bureau zegt dat het toch niet wordt gebruikt (update)
- Ja,
- Twin Monkeys voor het eerst gekloond als Dolly the Sheep
- Wat gebeurt er met plantaardige en dierlijke cellen wanneer ze worden geplaatst in hypertone, hypotone en isotone omgevingen?
- Waarom is DNA de blauwdruk van het leven?
- Onderzoekers verbeteren methode om gebruikte kathoden uit lithium-ionbatterijen te recyclen en te vernieuwen

- Kationmenging induceert zeer efficiënte natriumopslag voor gelaagde kathoden
- Het geheim achter kristallen die krimpen bij verhitting
- Wat zijn een atoom, elektron, neutron en proton?

- Snellere en goedkopere ethanol naar vliegtuigbrandstof in het verschiet

 Werd Noord-Amerika bevolkt door stapsteenmigratie over de Beringzee?
Werd Noord-Amerika bevolkt door stapsteenmigratie over de Beringzee? 'S Werelds grootste offshore windpark Walney Extension komt in actie voor energie
'S Werelds grootste offshore windpark Walney Extension komt in actie voor energie Risicovolle onderneming:verliezen door klimaatverandering in grote Europese kuststeden berekenen
Risicovolle onderneming:verliezen door klimaatverandering in grote Europese kuststeden berekenen Het klimaat warmt sneller op dan in de laatste 2, 000 jaar
Het klimaat warmt sneller op dan in de laatste 2, 000 jaar Canadese ijskappen verdwijnen, bevestiging van de wetenschappelijke voorspelling van 2017
Canadese ijskappen verdwijnen, bevestiging van de wetenschappelijke voorspelling van 2017 Hitachi gaat ABB's elektriciteitsnet kopen voor $ 7 miljard:rapport
Hitachi gaat ABB's elektriciteitsnet kopen voor $ 7 miljard:rapport What Is Pull-in Voltage?
What Is Pull-in Voltage?  Een vooruitgang in het maken van moleculaire films laat zien hoe moleculen reageren op twee fotonen van licht
Een vooruitgang in het maken van moleculaire films laat zien hoe moleculen reageren op twee fotonen van licht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

