
Wetenschap
Karakterisering van de structuur van een lid van de L-Aminozuur Transporter (LAT) familie
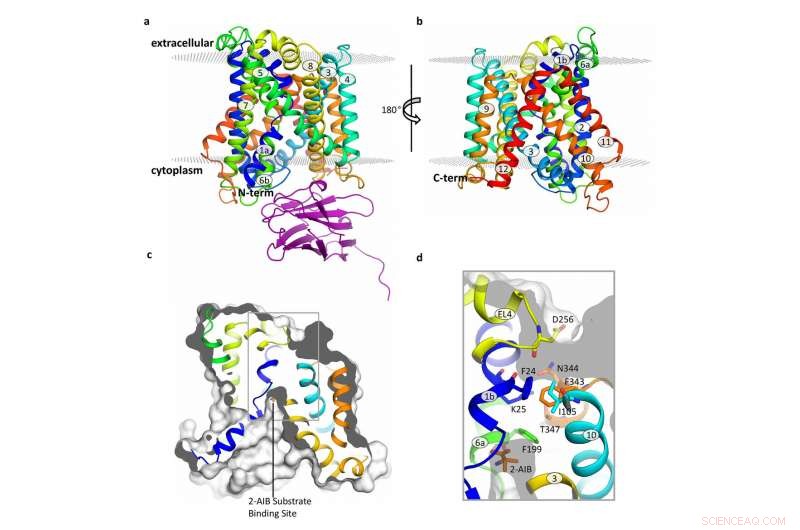
Structuur van de BasC-transporter. Krediet:Manuel Paladin, IRB Barcelona
In mensen, er zijn meer dan 50 soorten aminozuurtransporters, die verantwoordelijk zijn voor de cellulaire opname van aminozuren en voor het reguleren van de intra- en extracellulaire balans van deze moleculen. Mutaties in deze transporters worden in verband gebracht met een verscheidenheid aan ziekten. Echter, ondanks het belang van deze moleculen, er is weinig bekend over hoe ze werken. Wetenschappers van het Institute for Research in Biomedicine (IRB Barcelona) hebben nu de structuur van een lid van de LAT-familie gekarakteriseerd.
LAT's vormen een familie die verschillende soorten aminozuurtransporters omvat, en zijn zelfs aanwezig in sommige soorten bacteriën. Gemuteerde LAT's worden geassocieerd met aandoeningen zo divers als autisme, leeftijdsgerelateerd gehoorverlies, cystinurie en lysinurische eiwitintolerantie.
Gepubliceerd in het tijdschrift Natuurcommunicatie , deze studie heeft zich gericht op BasC, een LAT aanwezig in bacteriën. "We hebben BasC als model gebruikt omdat het structurele en functionele gelijkenis vertoont met LAT's bij mensen, " legt Manuel Palacín uit, hoofd van het Amino Acid Transporters and Disease Lab bij IRB Barcelona.
Door de structuur en functie van BasC te analyseren, de eerste auteurs van dit werk, Ekaitz Errasti-Murugarren, Joana Fort en Paola Bartoccioni, postdoctorale fellows bij IRB Barcelona, hebben de plaats geïdentificeerd waarop aminozuren aan LAT's binden en het mechanisme dat ten grondslag ligt aan de interactie aan beide zijden van het celmembraan.
"Weten hoe LAT's de aminozuren herkennen die naar de cel moeten worden getransporteerd, stelt ons in staat hun functie beter te begrijpen en de moleculaire defecten te ontcijferen die verband houden met verschillende aandoeningen. Deze kennis zal ons vervolgens helpen om mogelijke behandelingen te ontwikkelen, " opmerkingen Palacín, professor aan de Faculteit Biologie van de Universiteit van Barcelona, en hoofd van eenheid U731 van het Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER).
In deze samenwerking tussen IRB Barcelona, CIBERER, IBMB-CSIC en het Barcelona Supercomputing Center, de onderzoekers hebben de structuur van BasC gekarakteriseerd door middel van röntgenkristallografie en met behulp van een antilichaam tegen deze transporter. "De BasC-antilichamen die we hebben ontwikkeld, bieden een uitstekend hulpmiddel om de functie van deze transporter te bestuderen, ", voegt Palacin toe.
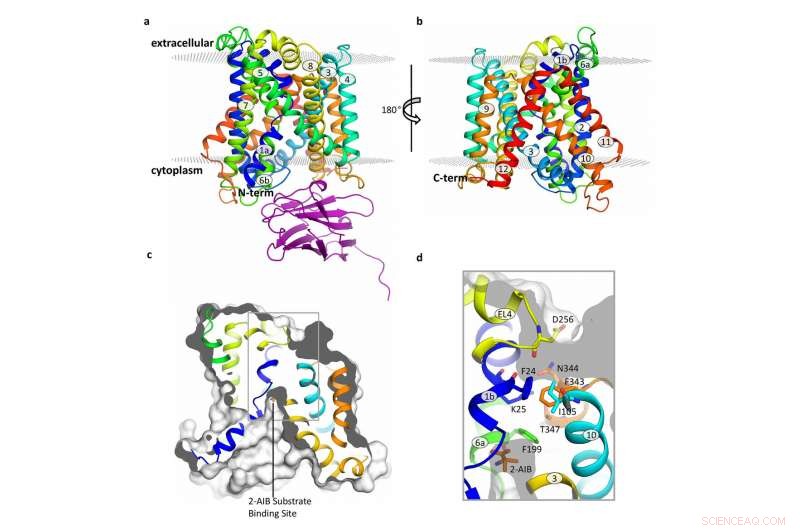
Structuur van de BasC-transporter. Krediet:Manuel Palacin, IRB Barcelona
 Nieuw maskermateriaal kan nanodeeltjes van virusgrootte verwijderen
Nieuw maskermateriaal kan nanodeeltjes van virusgrootte verwijderen Parfummakers zoeken natuurlijke, duurzame geuren
Parfummakers zoeken natuurlijke, duurzame geuren Vallen voor energiebronmoleculen in cellen
Vallen voor energiebronmoleculen in cellen Nieuwe techniek bereidt 2-D perovskiet-eenkristallen voor voor de hoogste fotodetectie
Nieuwe techniek bereidt 2-D perovskiet-eenkristallen voor voor de hoogste fotodetectie Nieuw centrum om olie en gas te vervangen door duurzame chemie
Nieuw centrum om olie en gas te vervangen door duurzame chemie
 Tyfoons in de Stille Oceaan kunnen meer intensiveren dan eerder werd voorspeld
Tyfoons in de Stille Oceaan kunnen meer intensiveren dan eerder werd voorspeld Onderzoekers ontdekken dat zwermen kleine organismen voedingsstoffen mengen in oceaanwater
Onderzoekers ontdekken dat zwermen kleine organismen voedingsstoffen mengen in oceaanwater Stalagmieten uit de Iraanse grot voorspellen een grimmige toekomst voor het klimaat in het Midden-Oosten
Stalagmieten uit de Iraanse grot voorspellen een grimmige toekomst voor het klimaat in het Midden-Oosten Menselijke activiteiten hebben de wereldwijde bodemerosie al gestimuleerd 4, 000 jaar geleden
Menselijke activiteiten hebben de wereldwijde bodemerosie al gestimuleerd 4, 000 jaar geleden Kolenhongerig Zuid-Afrika voert CO2-belasting in
Kolenhongerig Zuid-Afrika voert CO2-belasting in
Hoofdlijnen
- Drie voorbeelden van protisten met wetenschappelijke namen
- De zoektocht naar de zuidelijke rubberboa
- nieuwe ontdekking, meer bijen markeren Michigans eerst, volledige bijentelling
- Het risico op een keizersnede is erfelijk:natuurlijke selectie kan het aantal belemmerde bevallingen niet verminderen
- The Stages of the Human Decomposition Process
- Poema's zijn socialer dan eerder werd gedacht
- Vijf olifanten gedood door trein in India
- Wetenschappers ontdekken dat darmbacteriën in bijen antibioticaresistente genen naar elkaar verspreiden
- Ecologie: definitie, soorten, belang en voorbeelden
 Een wondermiddel voor de chemische omzetting van kooldioxide
Een wondermiddel voor de chemische omzetting van kooldioxide Facebook-firma over berichtversleuteling ondanks druk
Facebook-firma over berichtversleuteling ondanks druk Hoe zal de toekomst van architectuur de manier waarop we leven veranderen?
Hoe zal de toekomst van architectuur de manier waarop we leven veranderen?  Energiebronnen in de industriële revolutie
Energiebronnen in de industriële revolutie  Vermindering van individuele plantengroei verhoogt soms de veerkracht van de gemeenschap
Vermindering van individuele plantengroei verhoogt soms de veerkracht van de gemeenschap 3D-printen elektrisch ondersteund, op parelmoer geïnspireerde structuren met zelfgevoelige mogelijkheden
3D-printen elektrisch ondersteund, op parelmoer geïnspireerde structuren met zelfgevoelige mogelijkheden Oeroceanen hadden 250 miljoen jaar voor de atmosfeer zuurstof
Oeroceanen hadden 250 miljoen jaar voor de atmosfeer zuurstof Nieuw energieopslagapparaat kan elektrische voertuigen in enkele minuten opladen
Nieuw energieopslagapparaat kan elektrische voertuigen in enkele minuten opladen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






