
Wetenschap
Werkende eiwitten maken goed gebruik van frustratie
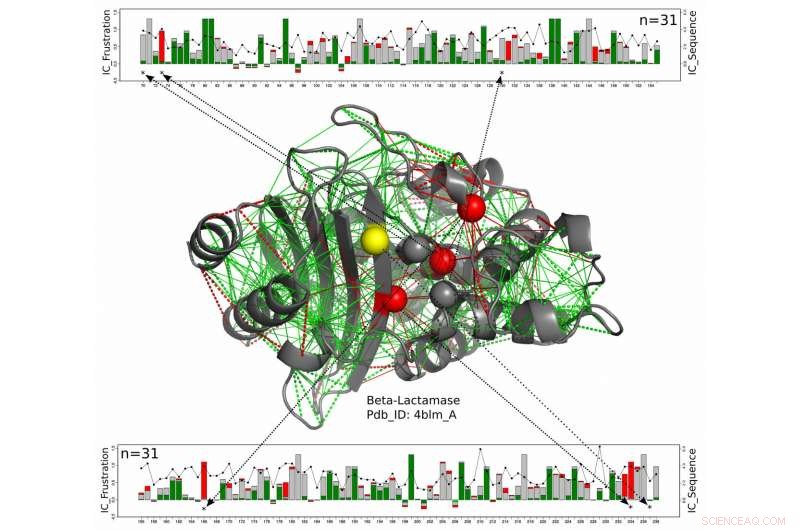
In dit structurele model voor een bèta-lactamase-eiwit, katalytische residuen worden weergegeven als bollen met die die consequent sterk gefrustreerd zijn langs de hele bèta-lactamasefamilie die in rood worden weergegeven en die waarvoor de gefrustreerde toestand niet behouden is in geel. Het nieuwe werk van wetenschappers van Rice University, de Universiteit van Buenos Aires en het European Molecular Biology Laboratory suggereren deze enzymen, die blootgesteld moeten blijven om te reageren met hun doelen, een zekere mate van bescherming krijgen tegen de enigszins gefrustreerde aminozuren om hen heen. De groene lijnen staan voor minimale frustratie, de rode lijnen vertegenwoordigen hoge frustratie. De lineaire grafieken boven en onder tonen de posities van de relevante aminozuren op de eiwitketen en een maat voor het behoud van energie over de hele bèta-lactamasen-eiwitfamilie. Credit:Maria Feiberger/Universiteit van Buenos Aires
Eiwitten vouwen volgens een script geschreven in het patroon van hun aminozuren. Maar om goed te kunnen functioneren, sommige delen moeten ad-lib.
De actieve plaatsen van enzymen, eiwitten die biochemische reacties versnellen en begeleiden, leven mogelijk maken. Om dit te doen, hun instructies moeten enigszins in strijd zijn met het algemene structuurplan van het eiwit, volgens wetenschappers van Rice University, de Universiteit van Buenos Aires en het European Molecular Biology Laboratory in Heidelberg, Duitsland.
Volgens de onderzoekers is evolutie heeft delen van enzymen geselecteerd als belangrijk genoeg om energetisch af te wijken van de instructies die leiden tot een vouwtrechter, die de eiwitten naar hun functionele lage energietoestanden leidt. Door in wezen alle bekende enzymen te onderzoeken, de onderzoekers bevestigden ook het vermoeden dat extra niveaus van meer zwak gefrustreerde interacties de katalytische sites zelf omringen en ondersteunen.
De theorie die wordt beschreven in de Proceedings van de National Academy of Sciences breidt het geaccepteerde principe van minimale frustratie uit dat verklaart waarom eiwitten soepel kunnen overgaan van de lineaire sequenties die oorspronkelijk in hun DNA waren gecodeerd naar hun werking, driedimensionale bolvormen. Dit principe erkent het feit dat frustratie vaak onopgelost blijft wanneer het resterende energetische conflict op de een of andere manier de functie van het eiwit dient.
Volgens Rice's Peter Wolynes, die het principe meer dan 20 jaar geleden in wiskundige vorm verkondigde, de energielandschappen van eiwitten met katalytische onderdelen zijn een extra analyse waard, gezien het belang dat de evolutie eraan heeft toegekend.
"Een perfect gevouwen molecuul, hoe mooi een sculptuur ook is, kan niet veel doen, "zei hij. "Je moet een eiwit hebben dat, terwijl het grotendeels opgevouwen is, heeft nog steeds een paar gefrustreerde scharnieren die niet compatibel zijn met vouwen, maar die nodig zijn om de beweging mogelijk te maken die nodig is voor chemische reacties."
Frustratie op atomair niveau is eenvoudig te ervaren:duw gewoon de positieve polen van twee magneten tegen elkaar en voel hoe ze terugduwen. Zoals magneten, de aminozuren van een vouwend eiwit trekken elkaar aan en stoten elkaar af als ze (meestal) conflicten oplossen en uiteindelijk een stabiele opstelling van contacten vormen.
"Voeg nu een derde magneet toe, en je kunt frustratie tegenkomen waar je niet vanaf komt, " zei co-auteur Wolynes, die werkte met het team van Buenos Aires onder leiding van biologisch chemicus Diego Ferreiro, een voormalig postdoctoraal onderzoeker in zijn groep.
De nieuwe studie toont aan dat frustratie bij de naburige aminozuren van het enzym, zoals in de situatie met de derde magneet, helpt het gefrustreerde enzym zijn mannetje te staan. Het blijft enigszins onstabiel maar heeft regio's die beschikbaar zijn om te binden met doelwitmoleculen en deze te modificeren.
Duidelijk, Wolynes zei, evolutie heeft prioriteiten die de esthetiek van het bereiken van een perfecte vouw overstijgen.
Het onderzoeksteam onderzocht op computerbasis honderden bekende eiwitstructuren en ontdekte dat hele families van enzymen kenmerkende kenmerken van actieve-sitefrustratie delen die zich uitstrekken tot de tweede en derde aminozuurlaag, of schelpen, rond het enzym.
"Het interessante dat we ontdekten, was dat frustratie over het algemeen verder gaat dan de absolute eerste schil, " zei hij. "Dat betekent dat er een onhandige maar noodzakelijke subtiliteit is aan de functionele beperkingen die vereisen dat deze drie schalen goed zijn."
Wolynes merkte op dat Nobelprijswinnaar Frances Arnold en anderen die kunstmatige evolutie in het laboratorium bestuderen, bewijs hebben gezien van langdurige frustratie bij hun pogingen om enzymen aan te passen voor nieuwe reacties.
"Soms veranderden ze specifiek de actieve site om andere chemische reacties dan de natuurlijke te katalyseren, maar ontdekte dat aminozuren op afstand van de actieve plaats ook moesten veranderen om het enzym efficiënt te laten werken, ' zei hij. 'Het was niet duidelijk waarom, maar de modellen laten zien dat veranderingen in de tweede en derde schil het katalytische vermogen van enzymen verbeteren.
"Dus onze resultaten waren geen complete schok, maar het is leuk om te zien dat langdurige frustratie vrij veel voorkomt in de natuur en een veelvoorkomend thema is in alle bekende enzymklassen, " hij zei.
 Biobased chemicaliën staan centraal
Biobased chemicaliën staan centraal Precisie-experimenten onthullen hiaten in de theorie van Van der Waals
Precisie-experimenten onthullen hiaten in de theorie van Van der Waals Hoe weet ik of iets is gereduceerd of geoxideerd
Hoe weet ik of iets is gereduceerd of geoxideerd Amerikaanse gigant Monsanto bekend om controversiële chemicaliën
Amerikaanse gigant Monsanto bekend om controversiële chemicaliën Hydrogels met fijngetande moleculaire kammen kunnen duurzame implantaten voor glucosemonitoring maken
Hydrogels met fijngetande moleculaire kammen kunnen duurzame implantaten voor glucosemonitoring maken
 De wereldwijde economische reactie op klimaatverandering:wat is het plan?
De wereldwijde economische reactie op klimaatverandering:wat is het plan? Dingen gevonden in de exosfeer
Dingen gevonden in de exosfeer Druk niet op de knop van onomkeerbare verandering:top klimaatwetenschapper
Druk niet op de knop van onomkeerbare verandering:top klimaatwetenschapper Green Deal wil van Europa het eerste klimaatneutrale continent maken in 2050
Green Deal wil van Europa het eerste klimaatneutrale continent maken in 2050 In China, maden eindigen platen, en voedselverspilling
In China, maden eindigen platen, en voedselverspilling
Hoofdlijnen
- Herstel van iconische inheemse vogel veroorzaakt problemen in stedelijke gebieden
- zeehonden, vogels en mensen strijden om vis in de Oostzee
- Wetenschappers maken volgnanoagentia om zeer kleine zieke weefsels te verlichten
- Who Discovered Ribosomes Structure?
- Hoe is de taal geëvolueerd?
- Structuur van het spierstelsel
- Wetenschappers controleren cellen met licht,
- Chemische stoffen gebruikt in DNA-analyse
- De nadelen van Western Blotting
- Superresolutiemicroscoop onthult geheimen van dodelijk Nipah-virus

- Definitie van zure oplossing

- De rol van coöperativiteit in hydrofobe interacties onthuld in realtime monitoring

- Simulatietechniek voorspelt microstructuren van legeringen die worden gebruikt in straalmotoren - voordat ze worden gemaakt

- Voeg gewoon nanomaterialen toe voor sterkere, hardere duikvinnen

 Damesrugzakken en mannelijk bier:de dwaasheid van gendergerelateerde producten
Damesrugzakken en mannelijk bier:de dwaasheid van gendergerelateerde producten Wat is de 5e dimensie?
Wat is de 5e dimensie?  Grafeen vormt de basis voor de volgende generatie THz-astronomiedetectoren
Grafeen vormt de basis voor de volgende generatie THz-astronomiedetectoren Stenen werktuigen in India suggereren een eerder vertrek van mensen uit Afrika
Stenen werktuigen in India suggereren een eerder vertrek van mensen uit Afrika MOF's kunnen lastige gassen detecteren en sorteren
MOF's kunnen lastige gassen detecteren en sorteren Hoe tirades op sociale media je kunnen blijven achtervolgen
Hoe tirades op sociale media je kunnen blijven achtervolgen Trump-regering zegt dat het het grootste zonnepark in de VS zal goedkeuren
Trump-regering zegt dat het het grootste zonnepark in de VS zal goedkeuren Klimaatverandering intensiveert droogtes in Europa
Klimaatverandering intensiveert droogtes in Europa
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

