
Wetenschap
Simulatie op atoomschaal van antiaritmische geneesmiddelinteractie met hartcellen

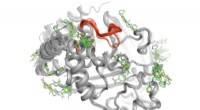
Om de mysterieuze mechanismen van de potentie van geneesmiddelen voor de behandeling van hartritmestoornissen te ontrafelen, UC Davis Health-onderzoekers hebben nieuwe simulaties ontwikkeld die inzicht verschaffen in vitale interacties tussen geneesmiddelen en hartcellen op atomaire schaal. Van links naar rechts:Vladimir Jarov-Yarovoy, Colleen Clancy, Phuong Tran Nguyen, Igor Vorobyov en Kevin DeMarco Van links naar rechts:Vladimir Yarov-Yarovoy, Colleen Clancy, Phuong Tran Nguyen, Igor Vorobyov en Kevin DeMarco Krediet:UC Regents
Om de mysterieuze mechanismen van de potentie van geneesmiddelen voor de behandeling van hartritmestoornissen te ontrafelen, een groep onderzoekers van UC Davis heeft nieuwe simulaties ontwikkeld die inzicht verschaffen in vitale interacties tussen geneesmiddelen en hartcellen op atomaire schaal.
Deze simulaties, vandaag gepubliceerd in PNAS ( Proceedings van de National Academy of Sciences ), kan leiden tot een betere ontwikkeling van nieuwe antiaritmica die zich richten op spanningsafhankelijke natriumkanalen (NaV), gespecialiseerde eiwitmoleculen in het hartcelmembraan.
Natriumkanalen dienen als poortwachters die de elektrische activiteit van hartcellen reguleren. Wanneer de elektrische signalen die de hartslagen coördineren niet goed werken, het hart kan onregelmatige hartslagen ervaren en wordt beschouwd als in een aritmische toestand.
Een klasse van anti-aritmica werkt op NaV-kanalen om de elektrische activiteit en het ritme van het hart te beïnvloeden. Nog, de langdurige mislukkingen in de medicamenteuze behandeling van hartritmestoornissen komen voornamelijk voort uit het onvermogen om de impact van ontwikkelde medicijnen op de activiteit van NaV en andere hartionkanalen te voorspellen.
"Vóór onze studie, er is geen effectieve preklinische methodologie om bruikbare of potentieel schadelijke geneesmiddelen op moleculair niveau te onderscheiden, " zei Vladimir Jarov-Yarovoy, universitair hoofddocent bij de afdeling Fysiologie en Membraanbiologie van UC Davis.
"Om nieuwe geneesmiddelen voor de behandeling van hart- en vaatziekten te ontwikkelen en te screenen en om hun bijwerkingen te minimaliseren, er is behoefte aan inzicht in het mechanisme van antiaritmische geneesmiddelinteracties met NaV-kanalen op atomaire schaal, " hij zei.
Dankzij verschillende technologische doorbraken en een toenemend aantal beschikbare structuren van ionenkanalen met hoge resolutie, zoals NaV, onderzoekers zijn nu in staat om deze structuren te simuleren en de activiteit van de hartcellen te moduleren door hun interacties met atomaire resolutie te bestuderen. De onderzoekers waren in staat om een model van het menselijke NaV-kanaal te bouwen op basis van de sterk gelijkende structuur van het NaV-kanaal van de elektrische paling met behulp van Rosetta computationele modelleringssoftware.
NaV-kanalen openen zich om de natriumionen in de hartcellen te laten stromen en sluiten binnen milliseconden. Wanneer de medicijnmoleculen deze kanalen binnenkomen, ze binden stevig aan de receptorplaats in het eiwit en voorkomen dat de natriumionen de cel binnendringen en de kanaalgeleiding blokkeren. Deze verandering in geleiding beïnvloedt de elektrische activiteit en het ritme van het hart.
In de ontwikkelde atomaire modelsimulaties, twee medicijnmoleculen worden gezien die overgaan in de centrale porie van het kanaal en binden aan de receptorplaats van het eiwit, waardoor de "hot spots" worden gevormd, gebieden waar de gunstigste geneesmiddel-eiwitinteractie plaatsvindt. Deze bindingsactiviteit triggert wat bekend staat als een hoge affiniteitstoestand van het kanaal.
"Hoge affiniteitstoestand van het kanaal wordt beschouwd als de belangrijkste toestand om het mechanisme van geneesmiddel-eiwitbinding te bestuderen. Nu en voor de eerste keer, we kunnen begrijpen hoe dit bindingsproces op atomaire schaal plaatsvindt, " voegde Yarov-Yarovoy eraan toe.
Simulaties van meerdere microseconden van lidocaïne (anti-aritmisch en lokaal anestheticum) in wisselwerking met natriumkanalen onthulden een toegangspad tot kanaalporiën door de intracellulaire poort en een nieuw toegangspad door een relatief kleine laterale opening die bekend staat als fenestratie.
Het combineren van moleculaire modelleringssoftware met simulaties om interacties tussen geneesmiddelen te bestuderen, is een nieuwe benadering die toekomstige geautomatiseerde virtuele screening van geneesmiddelen mogelijk maakt. Deze technologie kan op elk ionkanaal worden toegepast en zou meerdere behandelingen ten goede komen. uiteindelijk, deze benadering bevordert de precisiegeneeskunde door de reacties van individuele patiënten op medicamenteuze therapie te voorspellen op basis van de specifieke ionkanaalmutatie die de patiënt heeft.
 Nieuwe app stelt gebruikers in staat om te ontdekken hoe de opwarming van de aarde het klimaat van hun steden verandert
Nieuwe app stelt gebruikers in staat om te ontdekken hoe de opwarming van de aarde het klimaat van hun steden verandert Bosplanten aan de rand van het bestaan in tropisch Afrika
Bosplanten aan de rand van het bestaan in tropisch Afrika 68-jarige studie toont langetermijneffecten aan van het afbranden van bossen met regelmatige tussenpozen
68-jarige studie toont langetermijneffecten aan van het afbranden van bossen met regelmatige tussenpozen Bosbrand in Oregon verbrandt gebied bijna zo groot als Los Angeles
Bosbrand in Oregon verbrandt gebied bijna zo groot als Los Angeles Eerste studie over de impact van klimaatverandering in de Middellandse Zee
Eerste studie over de impact van klimaatverandering in de Middellandse Zee
Hoofdlijnen
- Wetenschappers onderzoeken de gevolgen voor de nationale veiligheid van genbewerking
- Hoe vogelgriep werkt
- Wat is de eerste stap in het decoderen van genetische berichten?
- Wat is de functie van aerobe ademhaling?
- Lysosoom: definitie, structuur en functie
- De rol van Taq Polymerase in PCR
- Er is een gemakkelijke manier om mitose en meiose te begrijpen
- Mummies buikjes om de evolutie van de spijsvertering te onthullen
- Wat gebeurt er met een Zygote na bevruchting?
- Onderzoekers ontdekken een manier om in eiwitten te kijken om te zien hoe ze zijn bedraad
- Assemblage van fluctuerende moleculen in kunstmatig celmembraan
- Video:Hoe chemie de warme chocolademelk kan verbeteren

- Video:Kameleons zijn meesters in nanotechnologie

- Lego-achtige chemische bouwstenen die zichzelf assembleren tot katalysator voor waterstofbrandstofcellen

 Duitsland zou over 10 jaar de laatste gletsjers kunnen verliezen
Duitsland zou over 10 jaar de laatste gletsjers kunnen verliezen Duistere meren overtreffen nu duidelijk, blauwe meren in de VS
Duistere meren overtreffen nu duidelijk, blauwe meren in de VS Duizenden geëvacueerd terwijl Australische bosbranden woeden
Duizenden geëvacueerd terwijl Australische bosbranden woeden 'S Werelds snelste door de mens gemaakte draaiende object kan helpen bij het bestuderen van de kwantummechanica
'S Werelds snelste door de mens gemaakte draaiende object kan helpen bij het bestuderen van de kwantummechanica Onderzoekers rapporteren nieuwe klasse polyethyleenkatalysator
Onderzoekers rapporteren nieuwe klasse polyethyleenkatalysator Satelliet vindt windschering die tropische storm Nadine treft
Satelliet vindt windschering die tropische storm Nadine treft Californische rook dreef in 2020 naar Europa en veroorzaakte zware vertroebeling van de zon
Californische rook dreef in 2020 naar Europa en veroorzaakte zware vertroebeling van de zon Klimaatverandering brengt de gezondheid in gevaar en economen hebben het juiste recept
Klimaatverandering brengt de gezondheid in gevaar en economen hebben het juiste recept
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

