
Wetenschap
Onderzoekers ontdekken een manier om in eiwitten te kijken om te zien hoe ze zijn bedraad
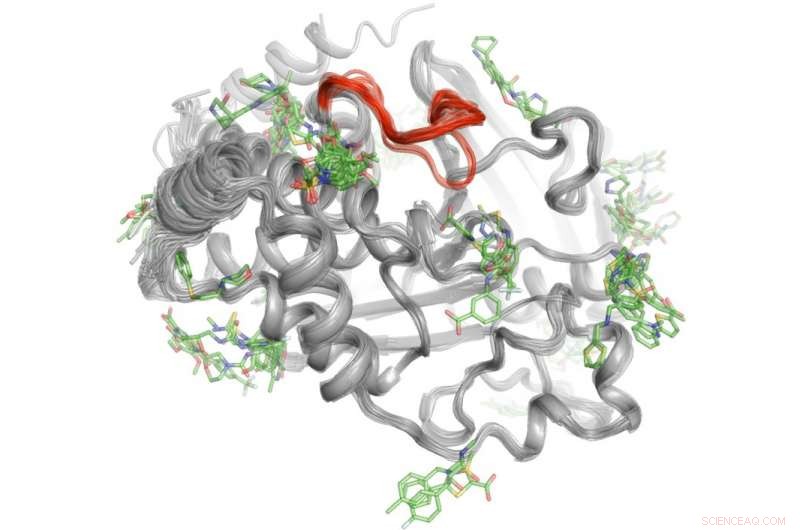
Een high-throughput-methode onthult waar meer dan 100 kleine moleculen binden aan het eiwit PTP1B. Een select aantal van deze bindingsgebieden kunnen signalen naar de actieve site (rood) sturen om de activiteit van PTP1B te controleren." Credit:Daniel Keedy
De eiwitten in ons lichaam zijn geavanceerde structuren die specifieke taken uitvoeren om ons te laten functioneren en gezond te houden. Vaak, deze kleine machines worden in- of uitgeschakeld via een proces in twee stappen waarbij een deel van het eiwit berichten stuurt naar een ander deel dat de "actieve site" wordt genoemd. " triggert het eiwit om zijn werk te starten of te stoppen. Soms wordt dit proces - bekend als allosterie - verstoord, die leidt tot of bijdraagt aan de ontwikkeling van bepaalde ziekten.
Begrijpen hoe een eiwit is bedraad, kan onderzoekers helpen manieren te ontwikkelen om de activiteit ervan te beheersen, en wetenschappers van het Advanced Science Research Center (ASRC) van The Graduate Center, CUNY, denken dat ze een betrouwbare manier hebben gevonden om dit te bepalen, volgens een nieuw gepubliceerde studie in eLife .
"Net zoals het moeilijk te raden is hoe een lichtschakelaar is aangesloten op een gloeilamp in een kamer zonder achter de muren te kijken, het is moeilijk te voorspellen welk afgelegen gebied van een eiwit verbonden is met zijn actieve plaats zonder de details in de structuur te zien, " zei Daniël Keyy, assistent-professor bij het ASRC Structural Biology Initiative en bij de scheikunde- en biochemieafdelingen van The City College of New York.
Om dit mysterie op te lossen, Keedy en zijn collega's onderzochten de signaleringscapaciteiten van eiwittyrosinefosfatase 1B (PTP1B), waarvan onderzoekers denken dat het een belangrijke rol speelt bij diabetes type 2 en mogelijk borstkanker. Ze gebruikten eerst röntgenkristallografie bij verschillende temperaturen om te zien hoe atomen in het eiwit bewegen. Dit onthulde specifieke gebieden waar de atomen bewegen als ruitenwissers of een Newton's Cradle-speeltje om berichten te verzenden. Volgende, het team voerde experimenten met hoge doorvoer uit met het eiwit om te bepalen welke kleine moleculen aan deze signaleringsplaatsen binden.
"Dit proces in twee stappen stelde ons in staat om niet alleen te zien waar de signalering binnen PTP1B vandaan komt, maar ook welke kleine moleculen in staat zijn om berichten naar de actieve site te sturen. Deze kennis zou ons op een dag kunnen helpen bij het ontwikkelen van therapieën die specifieke berichten sturen om de activiteit van een eiwit te beheersen en de ontwikkeling van diabetes type 2 te verstoren, ' zei Keyy.
"Ik ben heel enthousiast over de mogelijke toepassingen van Daniels werk, " zei Kevin Gardner, directeur van het ASRC Structural Biology Initiative en Einstein Professor of Chemistry and Biochemistry aan City College. "Deze techniek biedt een krachtige experimentele route om te vragen waar kleine moleculen kunnen binden aan eiwitdoelen, ontdekking en ontwikkeling van geneesmiddelen mogelijk maken door te laten zien waar men voorheen onverwachte 'steunpunten' zou kunnen vinden voor verbindingen om eiwitactiviteit te binden en te beheersen."
Keedy en zijn collega's hebben tot nu toe alleen naar PTP1B gekeken, maar hun methode maakt gebruik van gemakkelijk beschikbare technologieën die kunnen worden gebruikt om het proces van allosterie in veel andere belangrijke eiwitten in ons lichaam te bestuderen. Ze hopen een nieuw begrip te krijgen van hoe de functies van deze andere eiwitten worden gecontroleerd, die nuttig kunnen zijn voor de toekomstige ontwikkeling van nieuwe medicamenteuze therapieën.
 Onderzoekers rapporteren nieuwe toestand van materie beschreven als vloeibaar glas
Onderzoekers rapporteren nieuwe toestand van materie beschreven als vloeibaar glas Wetenschappers ontwikkelen nieuwe, goedkope tool voor het detecteren van bacteriën in voedsel en water
Wetenschappers ontwikkelen nieuwe, goedkope tool voor het detecteren van bacteriën in voedsel en water Biochemici onderzoeken het transport van grote eiwitten door bacteriële celmembranen
Biochemici onderzoeken het transport van grote eiwitten door bacteriële celmembranen Methoden voor waterzuivering
Methoden voor waterzuivering Onderzoekers ontdekken een nieuw mechanisme voor het werven van ARF-familie-eiwitten
Onderzoekers ontdekken een nieuw mechanisme voor het werven van ARF-familie-eiwitten
Hoofdlijnen
- Wat zijn drie dingen die bepalen of een molecuul in een celmembraan kan diffunderen?
- Hoe Ninja-deeltjes werken
- Nieuwe manier om te voorkomen dat genetisch gemanipuleerde en ongewijzigde organismen nakomelingen produceren
- Je lichaam doneren aan de wetenschap wordt steeds populairder in de VS
- Hoe de droogrot Serpula lacrymans zich aanpasten aan een nieuwe ecologische habitat
- Cryo-EM-beeldvorming suggereert hoe de dubbele helix scheidt tijdens replicatie
- Voor het eerst hebben wetenschappers levende bacteriën rechtstreeks waargenomen in poolijs en sneeuw
- Is de tweekamerige geest geëvolueerd om het moderne menselijke bewustzijn te creëren?
- Waar vindt transcriptie plaats in een eukaryote cel?
- SARS-CoV-2-enzym aanpakken met remmers
- Warmtegeleidend plastic kan leiden tot lichtere elektronica, auto's

- Wetenschappers persen katalysatoren in gastheermaterialen zoals een schip in een fles

- Slim bulkplastic reageert op licht, temperatuur en vochtigheid

- Gebruik maken van de zon om vers water te brengen naar afgelegen of door rampen getroffen gemeenschappen

 Uitbarsting van pasgeboren sterren in jonge sterrenhoop puzzels astronomen
Uitbarsting van pasgeboren sterren in jonge sterrenhoop puzzels astronomen Hoe wordt warmte overgedragen van de zon naar de aarde?
Hoe wordt warmte overgedragen van de zon naar de aarde?  Nieuwe studie zet verschillen in klimaatverandering op de kaart
Nieuwe studie zet verschillen in klimaatverandering op de kaart Afbeelding:De galactische dans van NGC 5394 en NGC 5395
Afbeelding:De galactische dans van NGC 5394 en NGC 5395 Waar geen ruimtevaartuig eerder is geweest:een nauwe ontmoeting met binaire asteroïden
Waar geen ruimtevaartuig eerder is geweest:een nauwe ontmoeting met binaire asteroïden Het verschil tussen gietijzer en gietstaal
Het verschil tussen gietijzer en gietstaal Survival of the least-fit:antiviraal middel richt zich selectief op de meest onaangename virussen
Survival of the least-fit:antiviraal middel richt zich selectief op de meest onaangename virussen Aardbevingsvoorspellingen komen een stap dichter bij de realiteit
Aardbevingsvoorspellingen komen een stap dichter bij de realiteit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | Dutch | Danish | Norway | Italian | German |

-
Wetenschap © https://nl.scienceaq.com

