
Wetenschap
Nieuwe dynamische sondes voor ionen die interageren met biomoleculen
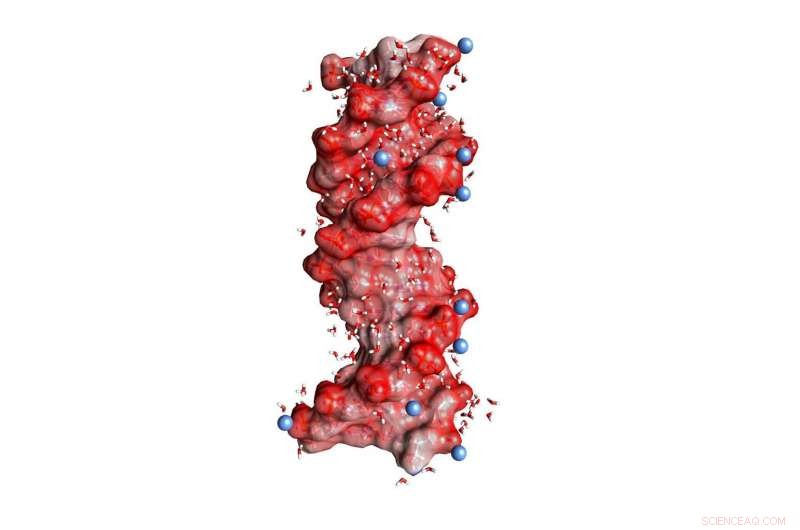
Fig. 1:DNA dubbele helix ingebed in water (gehoekte kleine moleculen, niet op schaal). De donkerrode bollen op het helixoppervlak stellen zuurstofatomen voor van de negatief geladen PO2-eenheden, de blauwe bollen positief geladen ionen in de omgeving. Krediet:MBI Berlijn
Paren van negatief geladen fosfaatgroepen en positieve magnesiumionen vertegenwoordigen een belangrijk structureel kenmerk van DNA en RNA ingebed in water. Trillingen van fosfaatgroepen zijn nu vastgesteld als selectieve sondes van dergelijke contactparen en maken het mogelijk om interacties en structuur in kaart te brengen op de ultrasnelle tijdschalen van moleculaire dynamica.
DNA en RNA zijn geladen polymeren die coderen voor genetische informatie in een dubbele helixstructuur en die een sleutelrol spelen in de biosynthese van eiwitten. Hun negatieve ladingen bevinden zich in de moleculaire ruggengraat, dat bestaat uit ionisch fosfaat (PO 2- ) en van suikergroepen (Figuur 1). Stabilisatie van de macromoleculaire structuren van DNA en RNA vereist een compensatie van sterke afstotende elektrische krachten tussen de gelijk geladen fosfaatgroepen door ionen van tegengestelde, d.w.z., positieve lading. In deze context, magnesium (Mg 2+ ) ionen zijn bijzonder relevant omdat ze niet alleen de structuur stabiliseren, maar ook de herkenning van externe bindingspartners bemiddelen en fungeren als katalytische centra. Bovendien, veranderingen van macromoleculaire structuur via dynamische vouwprocessen zijn verbonden met een herschikking van positieve ionen ingebed in de omringende waterschil.
Positieve ionen zijn gerangschikt in verschillende geometrieën rond DNA en RNA:in zogenaamde plaatsgebonden of contactpaargeometrieën, een positief ion bevindt zich in direct contact met een zuurstofatoom van een fosfaatgroep. In tegenstelling tot, de zogenaamde buitenste ionenatmosfeer bestaat uit positieve ionen die door ten minste één laag watermoleculen zijn gescheiden van de fosfaatgroepen. De functionele rol van de verschillende geometrieën en de onderliggende interacties worden nog lang niet begrepen. Een dieper inzicht op moleculair niveau vereist zeer gevoelige sondes die het mogelijk maken om de verschillende ionengeometrieën te onderscheiden zonder ze te verstoren, en voor het in kaart brengen van hun dynamiek op de ultrasnelle tijdschaal van moleculaire bewegingen.

Fig. 2:Boven:Moleculaire structuur van een contactionenpaar bestaande uit dimethylfosfaat (DMP) en een magnesiumion Mg2 ingebed in water. De pijlen markeren de verlengingen van de fosfor-zuurstofbindingen in de asymmetrische PO2-rektrilling. Onder:Tweedimensionale infrarood (2D-IR) spectra van de asymmetrische PO2-strekkende vibratie gemeten bij een wachttijd T=500 fs na vibratie-excitatie. De trillingsrespons wordt weergegeven als een functie van de infraroodexcitatie en de detectiefrequenties en bestaat uit een component P1 van DMP-moleculen zonder een magnesiumion in de buurt en de bijdrage P2 van contactionenparen. Deze laatste wordt door de interactie tussen PO2- en Mg2 naar hogere frequenties verschoven. Krediet:MBI Berlijn
In een recente publicatie, onderzoekers van het Max Born Institute (MBI) tonen aan dat trillingen van fosfaatgroepen gevoelige en niet-invasieve sondes van ionengeometrieën in een wateromgeving vertegenwoordigen. Dimethylfosfaat (DMP, (CH 3 O)2PO 2- ), een gevestigd modelsysteem voor de DNA- en RNA-ruggengraat, werd bereid in vloeibaar water met een overmaat Mg 2+ ionen (Figuur 2, top) en bestudeerd door niet-lineaire vibrationele spectroscopie in het femtoseconde tijdsdomein (1 fs =10 -15 s). De experimenten maken gebruik van tweedimensionale infrarood (2-D-IR) spectroscopie, een zeer geavanceerde methode voor het analyseren van de ionische interacties en structuren op de intrinsieke tijdschaal van fluctuerende moleculaire bewegingen.
De experimenten brengen Mg . in kaart 2+ ionen in direct contact met een PO 2- groep via een duidelijk kenmerk in het 2-D-IR-spectrum (Figuur 2, onderkant). De interactie met de Mg 2+ ion verschuift de asymmetrische PO 2- vibratie uitrekken tot een frequentie die hoger is dan bij afwezigheid van Mg 2+ ionen. De lijnvorm en de tijdsevolutie van deze nieuwe functie onthullen fluctuaties van de geometrie van het contactionenpaar en de ingesloten waterschil op een tijdschaal van honderden femtoseconden, terwijl het contactpaar zelf veel langer bestaat (~10 -6 s). Een diepgaande theoretische analyse toont aan dat de subtiele balans van aantrekkende elektrostatische (Coulomb) krachten en afstotende krachten als gevolg van de kwantummechanische uitwisselingsinteractie de frequentiepositie van de fosfaattrilling bepalen.
Het vermogen van 2-D-IR-spectroscopie om de korteafstands-fosfaat-ion-interactie in oplossing te karakteriseren, biedt een nieuw analytisch hulpmiddel dat een aanvulling vormt op de momenteel beschikbare structurele technieken. Een uitbreiding van deze nieuwe benadering van DNA en RNA en hun ionische omgeving is zeer veelbelovend en zal naar verwachting nieuw inzicht verschaffen in de krachten die evenwichtsstructuren stabiliseren en vouwprocessen aansturen.
 Team presenteert nieuwe synthesemethode voor klikchemie
Team presenteert nieuwe synthesemethode voor klikchemie Video:Hoe dubbelwerkend bakpoeder twee keer werkt
Video:Hoe dubbelwerkend bakpoeder twee keer werkt Koolstofnanobuisjes bootsen biologie na
Koolstofnanobuisjes bootsen biologie na Manipuleren van ketenlopen in olefinen met behulp van aarde-overvloedige op ijzer gebaseerde katalysatoren
Manipuleren van ketenlopen in olefinen met behulp van aarde-overvloedige op ijzer gebaseerde katalysatoren Make like a leaf:onderzoekers ontwikkelen methode om koolstofdioxide om te zetten
Make like a leaf:onderzoekers ontwikkelen methode om koolstofdioxide om te zetten
 Tropische cycloon Josies dodelijke overstromingsregen onderzocht met IMERG
Tropische cycloon Josies dodelijke overstromingsregen onderzocht met IMERG Onderzoek toont aan hoe gletsjeralgen een donkere zone creëren aan de randen van de Groenlandse ijskap
Onderzoek toont aan hoe gletsjeralgen een donkere zone creëren aan de randen van de Groenlandse ijskap De stranden van Tokio opruimen:een olympische taak
De stranden van Tokio opruimen:een olympische taak Nieuw model laat zien hoe diamantdragende rotsen zich vormden in Noord-Alberta
Nieuw model laat zien hoe diamantdragende rotsen zich vormden in Noord-Alberta 3 uitbarstende vulkanen in Alaska die lava of aswolken spuwen
3 uitbarstende vulkanen in Alaska die lava of aswolken spuwen
Hoofdlijnen
- Wat is de Chromatins-functie?
- Vergelijking & identificatie van kikkers en menselijke bloedcellen
- Oedogonium Life Cycle
- Wetenschappers ontdekken dat schorpioenen zich richten op hun gif
- Doorbraak kan tuinders helpen bij het zaaien van zaden
- Wat zijn twee kenmerken van mRNA in eukaryoten?
- Marmoset-baby's krijgen een boost van attente vaders
- Waar bevinden zich lipiden in het lichaam?
- Wat zijn de chemische zintuigen?
- Antiferromagnetische materialen grote stap richting commerciële toepassing
- Op zoek naar een uit-schakelaar voor coeliakie
- Nieuwe slimme materialen om wereldwijde uitdagingen aan te gaan

- Wetenschappers onderzoeken hoe verschillende vloeibare organellen in cellen worden gemaakt
- Eerste grootschalige studie van cocaïnegebruikers leidt tot doorbraak in drugstesten

 DNA-onderzoek toont neolithische Europeanen gekruist met Anatolische migranten
DNA-onderzoek toont neolithische Europeanen gekruist met Anatolische migranten Hoe de hulpbronnen van ouders de houding van hun kinderen ten opzichte van de toekomst vormen
Hoe de hulpbronnen van ouders de houding van hun kinderen ten opzichte van de toekomst vormen Hoe lang is elke maanfase?
Hoe lang is elke maanfase?  Innovatieve methode biedt een nieuwe manier om de ontwikkelingsbiomechanica van het hart te bestuderen, woon in 4-D
Innovatieve methode biedt een nieuwe manier om de ontwikkelingsbiomechanica van het hart te bestuderen, woon in 4-D Oudste man ter wereld sterft in Japan op 113
Oudste man ter wereld sterft in Japan op 113 Astronomen ontdekken eerste directe bewijzen van stolling van witte dwergsterren tot kristallen
Astronomen ontdekken eerste directe bewijzen van stolling van witte dwergsterren tot kristallen Moleculaire dansen bepalen hoe vloeistoffen warmte opnemen
Moleculaire dansen bepalen hoe vloeistoffen warmte opnemen Studie:Diepzeewezens die een feest of hongersnood leven vanwege energiestromen
Studie:Diepzeewezens die een feest of hongersnood leven vanwege energiestromen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | Dutch | Danish | Norway | French | German |

-
Wetenschap © https://nl.scienceaq.com

