
Wetenschap
Fluorescentie-activerend bèta-vat-eiwit voor het eerst helemaal opnieuw gemaakt
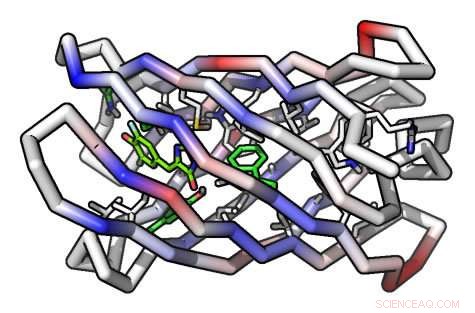
Een computermodel van een beta-barrel-eiwitmolecuul Credit:Institute for Protein Design/UW Medicine
Voor de eerste keer, wetenschappers hebben gemaakt, helemaal vanaf nul, een eiwit dat in staat is te binden aan een klein doelmolecuul. Onderzoekers van de University of Washington School of Medicine rapporteren de vooruitgang in het nummer van 12 september van het tijdschrift Natuur .
Eerder, dergelijke bindingseiwitten met kleine moleculen zijn gemaakt door eiwitten te veranderen die al in de natuur bestaan. Die aanpak beperkte de mogelijkheden aanzienlijk. Het vermogen om dergelijke eiwitten helemaal opnieuw te maken, of "de nieuwe, " opent de weg voor wetenschappers om eiwitten te maken die anders zijn dan in de natuur. Deze eiwitten kunnen op maat worden ontworpen met hoge precisie en affiniteit om te binden aan en te werken op specifieke kleine moleculedoelen.
De hoofdauteurs van het artikel zijn Jiayi Dou en Anastasia A. Vorobieva, beide senior fellows in het lab van senior auteur David Baker, hoogleraar biochemie aan de UW School of Medicine en directeur van het Institute of Protein Design aan UW Medicine. Baker is ook een onderzoeker bij het Howard Hughes Medical Institute.
De techniek moet breed worden toegepast in onderzoek, geneeskunde en industrie, volgens Bakker.
"Het succesvolle de novo-ontwerp van op maat gemaakte eiwitten met bindingsactiviteit met kleine moleculen vormt de basis voor de creatie van steeds geavanceerdere bindingseiwitten die niet de beperkingen zullen hebben die worden gezien met eiwitten die zijn ontworpen door bestaande eiwitstructuren te veranderen, " hij legde uit.
Om het eiwit te maken, de onderzoekers moesten nog een primeur bereiken:vanaf het begin een cilindervormig eiwit maken dat een bèta-vat wordt genoemd. De bèta-vatstructuur was ideaal omdat het ene uiteinde van de cilinder kon worden ontworpen om het eiwit te stabiliseren, terwijl het andere uiteinde zou kunnen worden gebruikt om een holte te creëren die kan dienen als de bindingsplaats voor het doelmolecuul.
Eiwitten zijn opgebouwd uit lange ketens van aminozuren. Eenmaal gesynthetiseerd, deze ketens vouwen zich in precieze vormen die de eiwitten in staat stellen hun functies uit te voeren. De vormen die deze kettingen aannemen zijn typisch ongelooflijk ingewikkeld, maar twee vaste kenmerken komen vaak voor:alfa-helices, die zich vormen wanneer de ketting van de secties rond een centrale as slingert, en bladachtige structuren, zogenaamde beta-sheets.
Beta-sheets worden gevormd wanneer twee of meer secties van verschillende delen van de aminozuurketen, vanwege het vouwen, lopen zij aan zij in de 3D-ruimte. Deze secties zijn "aan elkaar genaaid" door waterstofbruggen, het creëren van een bladachtige structuur. Deze beta-sheets, beurtelings, kan assembleren tot tonachtige structuren, bèta-vaten genoemd. In de natuur, beta-vaten eiwitten binden een breed scala aan kleine moleculen.
Om het nieuwe eiwit te ontwerpen, Dou en Vorobieva gebruikten een softwareplatform, ontwikkeld in het Baker-lab, Rosetta genoemd. Het kan voorspellen welke vorm een bepaalde keten van aminozuren zal aannemen na synthese en kan vertellen hoe het veranderen van individuele aminozuren langs de keten die vorm kan veranderen. Deze voorspellende kracht maakt het mogelijk om verschillende combinaties van aminozuren uit te testen om een eiwit te ontwerpen met de gewenste vorm en functie.
Om de holte te creëren, gebruikten de onderzoekers een krachtig nieuw docking-algoritme, genaamd "Rotamer Interaction Field" (RIF), ontwikkeld door William Sheffler, een senior onderzoeker in het Baker-lab. RIF identificeert snel alle mogelijke structuren van holtes die voldoen aan de vereisten voor het binden van specifieke moleculen.
Uitgerust met de nieuwe RIF-dockingmethoden, Doe jij, Vorobieva en Sheffler ontwierpen de bèta-vaten om een verbinding genaamd DFHBI te binden, een component die lijkt op wat zich in groen fluorescerend eiwit bevindt, die fluoresceert bij blootstelling aan bepaalde lichtfrequenties. Groen fluorescerend eiwit wordt routinematig gebruikt in biologisch onderzoek om moleculen en structuren in levende organismen te lokaliseren en hun beweging te volgen.

Anastasia A. Vorobieva. haar nieuwe zoon vasthoudend, met haar onderzoekscollega Jiayi Dou. De twee wetenschappers leidden het ontwerp en het testen van een bèta-barrel-eiwit dat fluorescentie activeert. Het nieuwe eiwit vanaf nul opgebouwd, is een vooruitgang in het op maat ontwerpen van eiwitten om zich precies op kleine moleculen te richten. Krediet:Institute for Protein Design/UW Medicine
In hun krant de onderzoeker toonde aan dat hun speciaal ontworpen eiwit de DFHBI-verbinding gretig bond en activeerde.
"Het werkte in bacteriële, gist- en zoogdiercellen, " zei Dou, "en half zo groot zijn als groen fluorescerend eiwit zou zeer nuttig moeten zijn voor onderzoekers."
Baker zei dat de aanpak onderzoekers in staat zal stellen een effectief onbeperkt aantal ruggengraatstructuren te verkennen met vormen die zijn aangepast om het betreffende molecuul te binden.
"Even belangrijk, " hij voegde toe, "het verbetert ons begrip van de determinanten van eiwitvouwing en -binding enorm, verder dan wat we hebben geleerd van het beschrijven van bestaande eiwitstructuren."
 Hoe de hoogste ionisatie-energie te bepalen
Hoe de hoogste ionisatie-energie te bepalen  Voor fotokatalysatoren, de tand des tijds doorstaan betekent een perfecte partner vinden
Voor fotokatalysatoren, de tand des tijds doorstaan betekent een perfecte partner vinden Acrylamide snijden in gefrituurde en gebakken snacks
Acrylamide snijden in gefrituurde en gebakken snacks Chemicus stelt zweetanalyse voor om elektronica beter te beveiligen
Chemicus stelt zweetanalyse voor om elektronica beter te beveiligen Eenden bieden onderzoekers een unieke kans om menselijke aanraking te bestuderen
Eenden bieden onderzoekers een unieke kans om menselijke aanraking te bestuderen
 Ruimte-orkaan voor het eerst waargenomen
Ruimte-orkaan voor het eerst waargenomen Stalagmietstudie biedt aanwijzingen over de magnetische polariteitsverschuivingen van de aarde in het verleden
Stalagmietstudie biedt aanwijzingen over de magnetische polariteitsverschuivingen van de aarde in het verleden tegen 2100, oceanen kunnen genoeg koolstof bevatten om de zesde massale uitroeiing van soorten te starten, wiskunde voorspelt (Update)
tegen 2100, oceanen kunnen genoeg koolstof bevatten om de zesde massale uitroeiing van soorten te starten, wiskunde voorspelt (Update) Stadsbomen kunnen hitte-eilanden in de buurt compenseren, onderzoeker zegt:
Stadsbomen kunnen hitte-eilanden in de buurt compenseren, onderzoeker zegt: Monstercycloon treft door COVID geteisterde westkust van India
Monstercycloon treft door COVID geteisterde westkust van India
Hoofdlijnen
- Nieuw onderzoek naar spermastamcellen heeft gevolgen voor mannelijke onvruchtbaarheid en kanker
- Effecten van mobiele telefoons op studenten
- Delen van een dierencel voor kinderen
- Mendels Experimenten: The Study of Pea Plants & Inheritance
- Welke chemische verbindingen zijn verantwoordelijk voor de smaken van bitter, zuur, zout en zoet?
- Wat is de elektrische impuls die een Axon naar beneden beweegt?
- Het gebit van de wedgefish lijkt ontworpen om schaaldieren te pletten, maar hij eet ook pijlstaartroggen
- Wat is het Geluksproject?
- Wat maakt DNA-vingerafdrukken uniek?
- Ontwerpen van selectieve membranen voor batterijen met behulp van een toolbox voor het ontdekken van medicijnen
- Onderzoekers ontwikkelen levensvatbare, milieuvriendelijk alternatief voor piepschuim

- Nieuwe methode ontwikkeld om antibioticaresten in voedsel uit dierlijke bronnen te extraheren

- Wetenschappers ontwikkelen supersnel opladen, kaliumbatterijen met hoge capaciteit

- Technologie verhoogt de output van microfluïdische onderzoeksgegevens 100-voudig

 Wat is polyethyleenglycol?
Wat is polyethyleenglycol?  De ruimtewedloop van miljardairs weerspiegelt een koloniale mentaliteit die zich geen andere wereld kan voorstellen
De ruimtewedloop van miljardairs weerspiegelt een koloniale mentaliteit die zich geen andere wereld kan voorstellen Wereldwijd gebruik van afvalwater voor irrigatie van landbouw minstens 50 procent groter dan gedacht
Wereldwijd gebruik van afvalwater voor irrigatie van landbouw minstens 50 procent groter dan gedacht Natuurlijk geperforeerde schelpen een van de vroegste versieringen in het Midden-Paleolithicum
Natuurlijk geperforeerde schelpen een van de vroegste versieringen in het Midden-Paleolithicum Hoe kaliumnitraat te detecteren
Hoe kaliumnitraat te detecteren Binnenkort verandert uw Cadillac handsfree van rijbaan met het verbeterde Super Cruise-systeem
Binnenkort verandert uw Cadillac handsfree van rijbaan met het verbeterde Super Cruise-systeem Als ons plan mislukt, kunnen we improviseren?
Als ons plan mislukt, kunnen we improviseren? Solar Dynamics Observatory vangt maanbevriezingsframe
Solar Dynamics Observatory vangt maanbevriezingsframe
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

