
Wetenschap
Designer-enzym gebruikt onnatuurlijk aminozuur voor katalyse
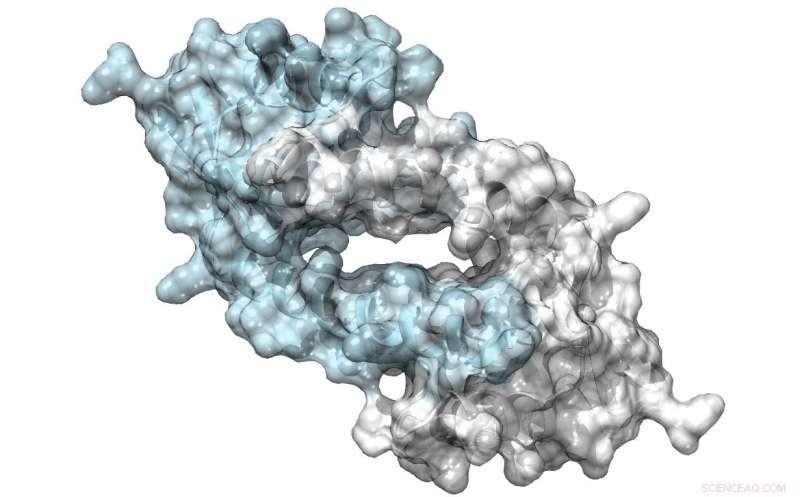
Structuur van LmR, een eiwit met een grote porie aan het dimeerinterface, die antibiotica kunnen binden of substraten kunnen werven om katalyse te ondergaan. Credit:Clemens Mayer / Rijksuniversiteit Groningen
Scheikundigen van de Rijksuniversiteit Groningen hebben een nieuw enzym gemaakt met een onnatuurlijk aminozuur als actief centrum. Ze maakten het enzym door een antibioticumbindend eiwit te modificeren dat normaal gesproken werkt als een bacteriële transcriptiefactor. Verdere modificaties van de reactieve plaats kunnen verschillende enzymen creëren voor gebruik bij chemische synthese. Een beschrijving van het nieuwe enzym werd gepubliceerd in Natuurchemie op 2 juli.
De chemische industrie werkt hard om conventionele processen te vervangen, die giftige chemicaliën of veel energie kunnen gebruiken, met milieuvriendelijkere alternatieven. Een populair alternatief zijn enzymen, die meestal functioneren in water bij gematigde temperaturen. Echter, het aantal reacties dat door natuurlijke enzymen wordt gekatalyseerd, is beperkt in vergelijking met wat er in de chemie beschikbaar is. "Daarom is het ontwerpen van enzymen de afgelopen jaren echt van de grond gekomen, ’ zegt RUG-hoogleraar Biomoleculaire Chemie Gerard Roelfes.
Verhoogde katalyse
Enzymen kunnen op verschillende manieren worden ontwikkeld. Nog, tot dusver, alleen de 20 natuurlijk voorkomende aminozuren zijn gebruikt om de actieve plaats van enzymen te creëren. Dit beperkt het aantal reacties dat deze ontworpen enzymen kunnen uitvoeren, stelt Roelfes:"We denken dat het opnemen van niet-standaard aminozuren in eiwitten het repertoire van designer-enzymen aanzienlijk zou kunnen uitbreiden."
Zijn team gebruikte een bacteriële transcriptiefactor als uitgangspunt voor hun ontwerp. Het LmrR-eiwit is een transcriptionele regulator in de bacterie Lactococcus lactis, die reageert op antibiotica; het katalyseert zelf geen chemische reacties. Het is een donutvormig dimeer met een centrale opening die hydrofobe moleculen bindt. Met behulp van uitgebreide genetische codetechnieken, Roelfes en zijn collega's brachten het onnatuurlijke aminozuur p-aminofenylalanine zo in het eiwit dat het aniline van de zijketen in de centrale opening aanwezig was. "Aniline is een bekende katalysator in chemische synthese, maar niet erg krachtig. Door het aan het LmrR-eiwit te introduceren, verhoogde katalyse met bijna drie ordes van grootte."

Eiwitstructuur van LmrR de porie. Wanneer een onnatuurlijk aminozuur, p-aminofenylalanine, wordt in deze porie gebracht, de inherente katalytische activiteit van de anilinezijketen (rode structuur) wordt met bijna drie ordes van grootte versterkt voor een model-hydrazonvorming. Credit:Clemens Mayer / Rijksuniversiteit Groningen
Verschillende reactiviteiten
Het nieuwe enzym verbindt organische moleculen door een hydrazonstructuur te vormen, een reactie die wordt gebruikt in de medische biotechnologie, bijvoorbeeld, om medicijnen te koppelen aan antilichamen. "Bij onze experimenten we gebruikten een reactie die een mooi gekleurd product geeft, dus we konden de activiteit van het nieuwe enzym gemakkelijk meten." Roelfes en zijn team passen nu de centrale opening aan om de efficiëntie van het enzym te verhogen en het af te stemmen op specifieke reacties.
"Er zijn veel opties om dit enzymontwerp te gebruiken in chemische synthese, " zegt Roelfes "En we zouden ook andere onnatuurlijke aminozuren kunnen introduceren die verschillende reactiviteiten hebben." Door deze nieuwe katalytische eigenschappen te combineren met de promiscue bindingsplaats van het LmrR-eiwit, Roelfes is ervan overtuigd dat er veel nieuwe bruikbare enzymen kunnen worden gemaakt.
 Wetenschappers gebruiken licht om vetzuren om te zetten in alkanen
Wetenschappers gebruiken licht om vetzuren om te zetten in alkanen Wetenschappers stellen nieuwe methode voor voor grootschalige productie van thermisch stabiele katalysatoren met één atoom
Wetenschappers stellen nieuwe methode voor voor grootschalige productie van thermisch stabiele katalysatoren met één atoom Verschil tussen spectrometer en spectrofotometer
Verschil tussen spectrometer en spectrofotometer  Hoe maak je van plastic afval in je prullenbak winst
Hoe maak je van plastic afval in je prullenbak winst Steel Vs. Gegalvaniseerde staalsterkte
Steel Vs. Gegalvaniseerde staalsterkte
 Verlaten boten van glasvezel laten overal ter wereld gifstoffen en microplastics vrij
Verlaten boten van glasvezel laten overal ter wereld gifstoffen en microplastics vrij Smog bestrijden ondersteunt zonne-energie
Smog bestrijden ondersteunt zonne-energie Nieuw onderzoek wijst op uitdagende aard van gevestigde belangen in de energietransitie
Nieuw onderzoek wijst op uitdagende aard van gevestigde belangen in de energietransitie VN-rapport over oceanen, bevroren zones:de feiten
VN-rapport over oceanen, bevroren zones:de feiten Soorten planten in de Indische Oceaan
Soorten planten in de Indische Oceaan
Hoofdlijnen
- Nieuwe studie verandert kijk op vliegende insecten
- Daling van huismus in verband met luchtvervuiling en slechte voeding
- Hoe biologische antropologie werkt
- Zijn mannen of vrouwen betere navigators?
- Wanneer gebeurt er wanneer mitose verkeerd gaat en in welke fase zal het verkeerd gaan?
- Maken regenachtige dagen je echt down?
- Een gemakkelijke manier om de schedelzenuwen te leren
- Soorten organismen die van plantencellen zijn gemaakt
- Poema's zijn socialer dan eerder werd gedacht
- Ontdekking kan microverontreinigingen uit het milieu verwijderen

- Goedkoop, schaalbare watersplitsing voedt de toekomstige waterstofeconomie

- Eenvoudige manier om scheikundeformules te leren

- Verbetering van de prestaties van een thermo-elektrisch materiaal door selectieve atomen gedeeltelijk te vervangen door kationen

- Nieuwe oppervlaktebehandeling kan de koelingsefficiëntie verbeteren

 Google gegrild in het Congres:wat staat er voor technologiebedrijven in het verschiet
Google gegrild in het Congres:wat staat er voor technologiebedrijven in het verschiet Principes van galvaniseren
Principes van galvaniseren Jongeren doen nog steeds liever boodschappen in de winkel, niet online
Jongeren doen nog steeds liever boodschappen in de winkel, niet online World of Warcraft gebruiken om de schermtijd van gamers te verkorten, verhoog de inkomsten van de maker
World of Warcraft gebruiken om de schermtijd van gamers te verkorten, verhoog de inkomsten van de maker Waarom stort een beetje sneeuw Groot-Brittannië in transportchaos?
Waarom stort een beetje sneeuw Groot-Brittannië in transportchaos? CubeSats:Vormgevingsmogelijkheden in de ruimte
CubeSats:Vormgevingsmogelijkheden in de ruimte Mogelijke lavabuis dakramen ontdekt nabij de Noordpool van de Maan
Mogelijke lavabuis dakramen ontdekt nabij de Noordpool van de Maan Gestroomlijnd proces opent de ontwikkeling van geneesmiddelen voor een nieuwe klasse steroïden
Gestroomlijnd proces opent de ontwikkeling van geneesmiddelen voor een nieuwe klasse steroïden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

