
Wetenschap
Nieuwe methode maakt fotograferen van enzymen mogelijk
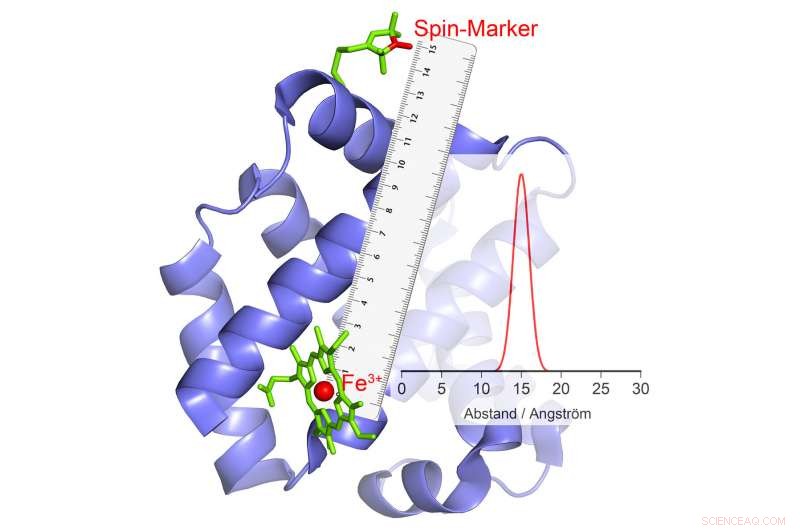
Als het van polariteit verandert, dit veroorzaakt een echo in de magnetische marker, waaruit de afstand kan worden berekend. Credit:© AG Schiemann/Uni Bonn
Wetenschappers van de Universiteit van Bonn hebben een methode ontwikkeld waarmee een enzym aan het werk kan worden "gefotografeerd". Hun methode maakt het mogelijk om de functie van belangrijke biomoleculen beter te begrijpen. Ook hopen de onderzoekers inzicht te krijgen in de oorzaken van bepaalde enzymstoornissen. De studie zal worden gepubliceerd in het tijdschrift Chemie – Een Europees tijdschrift .
Als een buitenaards wezen voor het eerst een afbeelding van een schaar ziet in een catalogus met knutselspullen, hij zou waarschijnlijk geen idee hebben waar wij aardbewoners dit ding voor gebruiken. Indien, anderzijds, hij zou een video te zien krijgen waarin de schaar open en dicht gaat, misschien zou hij met een beetje fantasie hun functie kunnen afleiden.
Wetenschappers hebben een zeer vergelijkbare benadering als ze willen begrijpen hoe een enzym werkt:als ze de structuur van het molecuul al kennen, dan meestal alleen als stilstaand beeld. Ze weten niet hoe het enzym zich in actie gedraagt, welke delen naar elkaar toe bewegen en welke delen van elkaar af bewegen.
Enzymen katalyseren bepaalde chemische reacties in de cellen, vergelijkbaar met een schaar die papier snijdt. Ze hebben katalytische centra (de bladen) die in contact komen met het uitgangsmateriaal (het papier). "De driedimensionale vorm van het enzym verandert meestal tijdens dit proces, " legt Prof. Dr. Olav Schiemann van het Instituut voor Fysische en Theoretische Chemie aan de Universiteit van Bonn uit. "Normaal gesproken, deze conformatieveranderingen kunnen niet zichtbaar worden gemaakt, of alleen met grote inspanning. Dit maakt het vaak moeilijk om het katalysemechanisme te begrijpen."
De onderzoeksgroep van Schiemann is erin geslaagd een methode te ontwikkelen waarmee tijdens katalyse de bewegingen van delen van het eiwit tegen elkaar gemeten kunnen worden. De Bonn-wetenschappers werken al enkele jaren met groot succes aan dergelijke methoden. In hun huidige studie ze hebben een bijzonder belangrijke groep enzymen onderzocht. Deze dragen metaalionen met talrijke ongepaarde elektronen in hun katalytische centra. Een voorbeeld is hemoglobine, dat met behulp van een ijzerion zuurstof bindt en zo in het bloed kan worden getransporteerd.
Flipping ionen
"Onze huidige methoden zijn ongeschikt voor dergelijke high-spin ionen, " legt Schiemanns collega Dr. Dinar Abdullin uit. "Daarom hebben we een nieuwe methode ontwikkeld, de theorie uitgewerkt en met succes getest." De onderzoekers maakten gebruik van het feit dat high-spin ionen zich gedragen als kleine elektromagneten. ze kunnen willekeurig hun polariteit veranderen - ze "draaien":de Noordpool wordt de Zuidpool en de Zuidpool wordt de Noordpool.
Dit fenomeen kan worden gebruikt voor afstandsmeting. Hier, de wetenschappers koppelen het enzym aan bepaalde chemische verbindingen die ook elektromagnetische eigenschappen hebben. "Als de high-spin ionen omslaan, deze kleine elektromagneten reageren op het veranderde magnetische veld in hun omgeving door ook hun polariteit te veranderen, " legt Abdullin uit. Wanneer en hoe ze dit doen, hangt af, onder andere, op de afstand tot het high-spin ion. Hierdoor is het mogelijk om de afstand tussen beide zo nauwkeurig te bepalen.
Als meerdere magnetische groepen aan één enzym zijn gebonden, de afstand van elk van deze groepen tot het hoogspin-ion en dus tot het katalytische centrum wordt verkregen. "Door deze waarden te combineren, we kunnen de ruimtelijke positie van dit centrum meten, alsof we een moleculaire GPS gebruiken, " legt Schiemann uit. "Bijvoorbeeld we kunnen bepalen hoe zijn positie verandert ten opzichte van de andere magnetische groepen in de loop van katalyse."
Echter, de wetenschappers kunnen het enzym nog niet echt aan het werk zien. "We werken nog steeds met bevroren cellen, ", zegt Schiemann. "Deze bevatten talloze enzymen die tijdens de katalytische reactie op verschillende tijdstippen zijn ingevroren. We krijgen dus geen film, maar een reeks "stills - alsof de schaar uit het inleidende voorbeeld op talloze verschillende momenten tijdens het montageproces is gefotografeerd.
"Maar we zijn al bezig met de volgende verbetering, benadrukt de chemicus:"Het ruimtelijk meten van biomoleculen in cellen en bij kamertemperatuur." De onderzoekers hopen inzicht te krijgen in het ontstaan van bepaalde ziekten die worden uitgelokt door functiestoornissen van enzymen.
 In levende kleur:cellen van buiten het lichaam zien met synthetische bioluminescentie
In levende kleur:cellen van buiten het lichaam zien met synthetische bioluminescentie Ontdekking van hoe mensen de geur van de dood ervaren, kan levens redden
Ontdekking van hoe mensen de geur van de dood ervaren, kan levens redden Thermisch geleidende polyimidefilm:een betere manier om warmte in elektronische apparaten af te voeren
Thermisch geleidende polyimidefilm:een betere manier om warmte in elektronische apparaten af te voeren Hoe u redox-vergelijkingen in evenwicht kunt brengen
Hoe u redox-vergelijkingen in evenwicht kunt brengen Waarom lost piepschuim op terpentijn?
Waarom lost piepschuim op terpentijn?
 NASA's Terra Satellite ziet het einde van Bavi
NASA's Terra Satellite ziet het einde van Bavi Hoe de man en vrouw te vertellen Zebravis Apart
Hoe de man en vrouw te vertellen Zebravis Apart NASA-satelliet vindt een wigvormige tropische storm Paulette
NASA-satelliet vindt een wigvormige tropische storm Paulette De vitale functies van de aarde verslechteren naarmate de impact van de mensheid groter wordt
De vitale functies van de aarde verslechteren naarmate de impact van de mensheid groter wordt Verborgen koolstofbron gevonden aan de Arctische kust
Verborgen koolstofbron gevonden aan de Arctische kust
Hoofdlijnen
- Hoe robots de productiecrisis van antibiotica kunnen oplossen
- Studie maakt ingang naar landbouw zwanenhals zeepokken
- 25 nieuwe genomen om 25 jaar Sanger Institute te vieren
- Zijn linkshandigen snellere denkers dan rechtshandigen?
- NASA Twins-onderzoek wordt gerepliceerd op Everest
- Hogere biodiversiteit door rivierverruimende maatregelen
- Vissen gebruiken doofheidsgen om waterbeweging waar te nemen
- Wat is de functie van een Tris-buffer in DNA-extractie?
- Parasitaire ooginfectie vormt een aanzienlijke bedreiging voor Britse honden, waarschuw experts
- Stop die BPA-vrije drinkflessen in de vaatwasser voordat je ze gebruikt

- Nieuw polymeer pakt PFAS-vervuiling aan
- De harige buik van honingbijen laat zien hoe je energie kunt besparen, slijtage aan materialen verminderen

- Wetenschappers ontwikkelen technologie om tumorcellen te vangen

- Veranderingen in de dynamiek en structuur van watermoleculen in de buurt van opgeloste stoffen in kaart brengen

 Onderzoekers boren diep om te begrijpen waarom de aardbeving op Sumatra zo hevig was
Onderzoekers boren diep om te begrijpen waarom de aardbeving op Sumatra zo hevig was Koolwaterstoffen verteren
Koolwaterstoffen verteren Bioplastics bevatten stoffen die net zo giftig zijn als die in gewone plastics
Bioplastics bevatten stoffen die net zo giftig zijn als die in gewone plastics in eerste, wetenschappers traceren snelste zonnedeeltjes naar hun wortels op de zon
in eerste, wetenschappers traceren snelste zonnedeeltjes naar hun wortels op de zon Röntgenbeelden met een aanzienlijk verbeterde resolutie
Röntgenbeelden met een aanzienlijk verbeterde resolutie Vijf dingen die u moet weten over NASA's Deep Space Atomic Clock
Vijf dingen die u moet weten over NASA's Deep Space Atomic Clock Mars heeft een echt meer
Mars heeft een echt meer  Klimaatverandering heeft gevolgen voor de habitat van de Antarctische biodiversiteit
Klimaatverandering heeft gevolgen voor de habitat van de Antarctische biodiversiteit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

