
Wetenschap
Metabolieten in algen cel voor cel meten
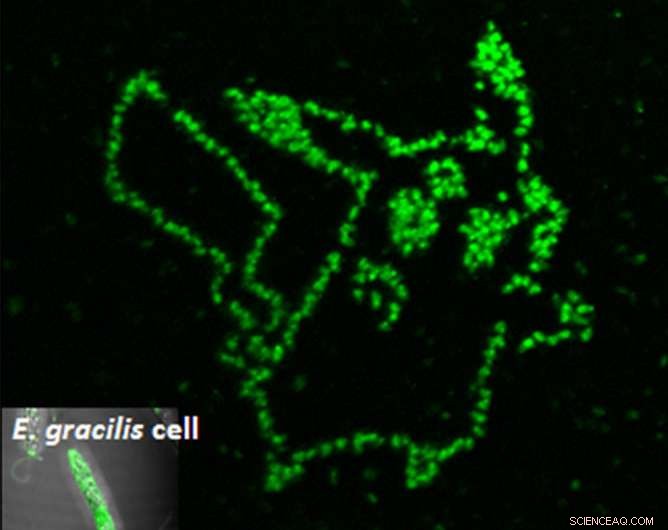
De fotoporatie van een fluorogene aptameer in afzonderlijke microalgencellen laat precies zien waar de gewenste metaboliet zich bevindt. Krediet:Yoichiroh Hosokawa
Op zoek naar nieuwe bronnen van verbruiksartikelen, wetenschappers zijn gaan beseffen dat het leven zelf de oplossing zou kunnen zijn. Metabolische ingenieurs hebben het metabolisme van levende organismen veranderd om nieuwe medicijnen te maken, biologisch afbreekbare stoffen en biobrandstoffen. Een van de beste voorbeelden in de moderne tijd is penicilline. Metabolische engineeringbacteriën hebben de productiesnelheid van dit medicijn meer dan 100 keer verbeterd.
Een grote uitdaging op dit gebied is om te bepalen welke cellen het meest productief zijn. Het is relatief eenvoudig om bulkpopulaties te bestuderen, wat resulteert in informatie over het metabolisme van de totale celpopulatie. Echter, het blijft uiterst moeilijk om te identificeren welke cellen in de bulkpopulatie boven de rest uitsteken in termen van metabolietproductie en daarom het beste zijn om te kopiëren en te imiteren. Deze identificatie vereist het observeren van de innerlijke processen van individuele cellen in realtime terwijl de metaboliet wordt gemaakt. Wetenschappers van het Nara Institute of Science and Technology (NAIST) rapporteren een nieuw systeem dat dit doel bereikt in microalgencellen. Het systeem combineert fluorogene aptameren met femtoseconde laserfotoporatie. De studie is gepubliceerd in Wetenschappelijke rapporten .
"Algen hebben een aantal aantrekkelijke eigenschappen voor metabolic engineering. Ten eerste, ze zijn extreem adaptief, omdat ze in staat zijn om in een breed scala van omgevingen te leven, van de evenaar tot de polen en zelfs in sterk zoute of vervuilde wateren, " zegt professor Yoichiroh Hosokawa, die de studie leidde.
Normaal gesproken, wetenschappers gebruiken fluorescentiemicroscopie om in een cel te kijken. Deze strategie omvat het bevestigen van een molecuul dat fluoresceert aan de metaboliet van belang. Echter, vanwege celwandbescherming, het was moeilijk om fluorescerende moleculen te introduceren die van buitenaf specifieke metabolieten in microalgencellen detecteren.
Het team van Hosokawa heeft daarom fluorescerende aptameren ontwikkeld die fluorescentie uitzenden bij binding aan de metaboliet paramylon en productiemethoden die ze door laserpulsen in de cel kunnen introduceren.
"We hebben een peptide-aptameer gesynthetiseerd dat bindt aan paramylon, en introduceerde het in Euglena gracilis-cellen door middel van laserverwerking met één cel, " zei dr. Takanori Maeno, wie de eerste auteur van de studie was. "Paramylon wordt alleen door Euglena geproduceerd en functioneert als vezels. Het kan worden geraffineerd tot biobrandstoffen, " hij voegde toe.
Om de aptamer in de cel te krijgen, de wetenschappers schoten de cellen met laserpulsen van slechts femtoseconden lang. Deze pulsen creëerden tijdelijke poriën die groot genoeg waren om de aptameren binnen te laten. Eenmaal binnen, de cellen werden alleen groen op plaatsen waar de aptameren aan paramylon bonden. Met behulp van deze techniek, Hosokawa's groep kon de accumulatie van paramylon in de tijd meten, waardoor efficiënte cellen worden onderscheiden van hun onproductieve buren.
Hoewel het systeem alleen op paramylon is getest, Hosokawa stelt dat andere metabolieten detecteerbaar zullen zijn met geschikte aptameren.
"Onze methode geeft ruimtelijke en temporele informatie over intracellulaire doelparamylon, maar zou in de toekomst voor alle soorten metabolieten moeten werken. Het is handig voor het selecteren van hoogwaardige cellen, " hij zei.
 Bioactieve natuurlijke verbindingen voor de strijd tegen kanker
Bioactieve natuurlijke verbindingen voor de strijd tegen kanker Kationmenging induceert zeer efficiënte natriumopslag voor gelaagde kathoden
Kationmenging induceert zeer efficiënte natriumopslag voor gelaagde kathoden Afvalplastic omgezet in filtratiemembranen
Afvalplastic omgezet in filtratiemembranen Een manier om de absolute stereochemie van kleine, organische moleculen
Een manier om de absolute stereochemie van kleine, organische moleculen Methode onderzoekt snel het vermogen van atoomdunne materialen om waterstof te produceren
Methode onderzoekt snel het vermogen van atoomdunne materialen om waterstof te produceren
Hoofdlijnen
- Zwaarlijvige honden geholpen door effectieve gewichtsverliesproeven
- Hoe neemt een slijmvorm beslissingen zonder hersenen?
- Top 5 manieren om plezier te hebben in 2050
- De 3 soorten bacteriën
- Wat zijn de monomeren van triglyceriden?
- Verschillen in mannelijke en vrouwelijke chromosomen
- Hoe zijn ggo's gemaakt?
- Onderzoekers vinden eerste wilde alligator brekende schildpad in Illinois sinds 1984
- Namen van de enzymen in de mond & slokdarm
- Het benutten van omkeerbare oplosbaarheid zorgt voor directe, optische patronen van ongekend kleine features.

- Zuren en basen Gevonden in huizen

- Onderzoekers maken potentiële doorbraak in de ontwikkeling van kankergeneesmiddelen

- Gezonde organellen, gezonde cellen

- Hoe smelt- en kookpunten te berekenen met behulp van molaliteit

 China onthult nieuw ruimtestation Heavenly Palace terwijl ISS-dagen geteld zijn
China onthult nieuw ruimtestation Heavenly Palace terwijl ISS-dagen geteld zijn Kaliumjacht op eiwitfabrieken
Kaliumjacht op eiwitfabrieken Tornado waarschuwing? in het oosten, stormseizoen brengt verbijstering (update)
Tornado waarschuwing? in het oosten, stormseizoen brengt verbijstering (update) Hoe voeden fruitbatterijen een LED-lamp?
Hoe voeden fruitbatterijen een LED-lamp?  Onderzoekers ontdekken tekenen van ineenstorting van ecosystemen in significant PNG-wetland
Onderzoekers ontdekken tekenen van ineenstorting van ecosystemen in significant PNG-wetland Onderzoekers ontdekken nieuwe transportroute voor vluchtige plantenstoffen
Onderzoekers ontdekken nieuwe transportroute voor vluchtige plantenstoffen Het heelal in kaart brengen in 3D
Het heelal in kaart brengen in 3D Nieuwe tool maakt surfen op het web gemakkelijker voor slechtzienden
Nieuwe tool maakt surfen op het web gemakkelijker voor slechtzienden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Dutch | Danish | Norway | Swedish | German |

-
Wetenschap © https://nl.scienceaq.com

