
Wetenschap
Onderzoek verbetert het enzym dat plastic afbreekt
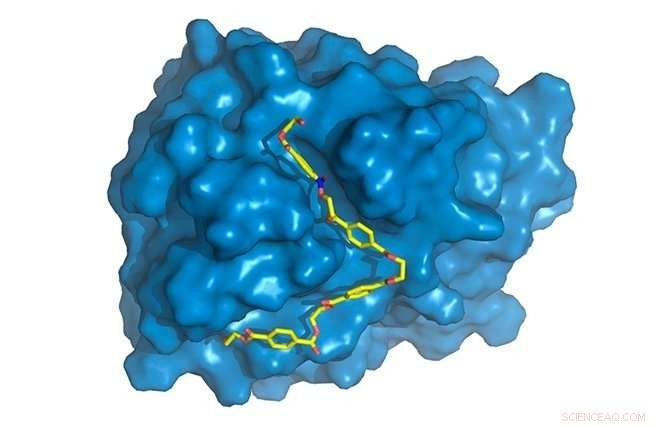
PETase wordt weergegeven in blauw, met PET-keten (geel) gebonden aan actieve site, waar het zal worden afgebroken. Krediet:Rodrigo Leandro Silveira
Sinds het werd ontdekt, het enzym dat bekend staat als PETase heeft veel wetenschappelijke belangstelling gewekt vanwege zijn vermogen om PET (polyethyleentereftalaat) te verteren.
Een polymeer dat voornamelijk wordt gebruikt om drinkflessen (maar ook kleding, tapijten, en andere producten), PET heeft het nadeel dat het bestand is tegen afbraak. Flessen en andere voorwerpen gemaakt van PET (polyethyleentereftalaat) hebben minstens 800 jaar nodig om biologisch af te breken op stortplaatsen of in de zee. Jaarlijks wordt tussen de 4,8 miljard en 12,7 miljard kilo plastic in de oceanen gedumpt.
Een studie met resultaten die onlangs in het tijdschrift zijn gepubliceerd Proceedings van de National Academy of Sciences ( PNAS ) liet zien hoe een internationaal team van medewerkers erin slaagde de capaciteit van PETase om plastic af te breken, te vergroten.
"In ons onderzoeksproject we karakteriseerden de driedimensionale structuur van het enzym dat dit plastic kan verteren, ontworpen om zijn degradatiecapaciteit te vergroten, en toonde aan dat het ook inwerkt op polyethyleen-2, 5-furandicarboxylaat (PEF), een PET-vervanger gemaakt van hernieuwbare grondstoffen, " zei co-auteur Rodrigo Leandro Silveira, een postdoctoraal onderzoeker aan het Chemistry Institute van de Universiteit van Campinas (IQ-UNICAMP).
Een bacterie die het metaboliseren van PET overleeft
Interesse in PETase ontstond in 2016, toen een groep Japanse onderzoekers onder leiding van Shosuke Yoshida een nieuwe bacteriesoort identificeerde, Ideonella sakaiensis, die zich kunnen voeden met PET door het te gebruiken als een bron van koolstof en energie. De bacterie blijft het enige bekende organisme met dit vermogen. Het groeit letterlijk op PET.
"Naast het identificeren van I. sakaiensis, de Japanse wetenschappers ontdekten dat het twee enzymen produceert en deze afscheidt in het milieu, " verklaarde Silveira. "Een van de uitgescheiden enzymen is PETase. Omdat het een zekere mate van kristalliniteit heeft, PET is een polymeer dat zeer moeilijk af te breken is. Maar PETase valt het aan en breekt het af in kleine eenheden mono(2-hydroxyethyl)tereftaalzuur, of MHET. De eenheden van MHET worden vervolgens omgezet in tereftaalzuur en geabsorbeerd en gemetaboliseerd door de bacterie."
I. Sakaiensis is het enige levende organisme waarvan bekend is dat het een door mensen vervaardigd synthetisch molecuul gebruikt om te overleven. Dit betekent dat de bacterie het resultaat is van een zeer recent evolutionair proces dat zich de afgelopen decennia heeft voltrokken. De bacterie heeft zich aangepast aan een polymeer dat begin jaren veertig werd ontwikkeld en pas in de jaren zeventig op industriële schaal werd gebruikt. PETase is de sleutel om te begrijpen hoe.
"PETase doet het moeilijkste deel, die de kristalstructuur afbreekt en PET depolymeriseert tot MHET, " zei de door FAPESP gefinancierde onderzoeker. "Het werk van het tweede enzym, die de MHET omzet in tereftaalzuur, is veel eenvoudiger, omdat het substraat bestaat uit monomeren waar het enzym gemakkelijk bij kan omdat ze in het reactiemedium zijn gedispergeerd. Om deze reden, onderzoek heeft zich gericht op PETase."
Gemodificeerd enzym bindt beter aan polymeer
De volgende stap was om PETase in detail te bestuderen, de bijdrage van het nieuwe onderzoeksproject. "We hebben ons gericht op het ontdekken wat PETase het vermogen geeft om iets te doen dat andere enzymen niet erg efficiënt kunnen doen. We begonnen met het karakteriseren van de 3D-structuur van dit eiwit, ' legde Silveira uit.
"Het verkrijgen van de 3D-structuur betekent het ontdekken van de x, y- en z-coördinaten van elk van de duizenden atomen waaruit het macromolecuul bestaat. Onze Britse collega's deden dit met behulp van een bekende en veelgebruikte techniek genaamd röntgendiffractie, beschikbaar in een laboratorium dat erg lijkt op Sirius, nu in aanbouw in Campinas."
Nadat ze de 3D-structuur hadden verkregen, de onderzoekers begonnen PETase te vergelijken met verwante eiwitten. De naaste verwant is een cutinase van de bacterie Thermobifida fusca die cutine afbreekt, een soort natuurlijke vernis op de bladeren van planten. Bepaalde pathogene micro-organismen gebruiken cutinase om de cutinebarrière en geschikte voedingsstoffen in bladeren af te breken.
"We vonden enkele specifieke verschillen in PETase in vergelijking met cutinase in het gebied van het enzym waar de chemische reacties plaatsvinden, bekend als de actieve site. PETase heeft een meer open actieve site, bijvoorbeeld, Silveira zei. "We bestudeerden de moleculaire bewegingen van het enzym door middel van computersimulaties, het deel waar ik het meest aan heb bijgedragen. Terwijl kristalstructuur, verkregen door röntgendiffractie, verstrekte statische informatie, simulaties gaven ons dynamische informatie en stellen ons in staat om de specifieke rol van elk aminozuur in het PET-afbraakproces te ontdekken."
De fysica van de bewegingen van het molecuul is het resultaat van elektrostatische aantrekking en afstoting van een groot aantal atomen en van temperatuur. Computersimulaties stelden de onderzoekers in staat om beter te begrijpen hoe PETase bindt en interageert met PET.
"We ontdekten dat PETase en cutinase twee verschillende aminozuren hebben op de actieve plaats. Vervolgens gebruikten we moleculair-biologische procedures om mutaties in PETase te produceren met als doel het om te zetten in cutinase, ' zei Silveira.
‘Als we dat zouden kunnen, we zouden uitzoeken welke componenten het deze unieke eigenschap gaven om PET af te breken. Echter, tot onze verbazing, toen we probeerden deze specifieke activiteit van PETase te onderdrukken - door te proberen PETase om te zetten in cutinase - produceerden we een nog actievere PETase. We hebben geprobeerd zijn activiteit te verminderen, en in plaats daarvan hebben we het versterkt."
Er waren meer computersimulaties nodig om te begrijpen waarom de gemuteerde PETase beter was dan de originele PETase. Modellering en simulaties toonden duidelijk aan dat de veranderingen die in het oorspronkelijke PETase werden geproduceerd, de binding van het enzym aan het substraat vergemakkelijkten. Deze binding is zowel afhankelijk van de geometrie, met twee moleculen die in elkaar passen als sleutel en sleutelgat, en op de thermodynamische factoren die betrokken zijn bij de interacties tussen de verschillende componenten van het enzym en het polymeer. De elegante manier om dit te beschrijven is dat het gemodificeerde PETase een "grotere affiniteit" heeft voor het substraat.
Wat betreft het verkrijgen van een enzym dat tonnen plastic afval kan verteren, de studie was een groot succes, maar waarom PETase PETase is, blijft een mysterie.
Hoofdlijnen
- Lake Michigan watervogels botulisme sterfgevallen in verband met warm water, algen
- Glycolyse aan kinderen leren
- Intra-rij onkruid wieden mogelijk met vision-systemen
- Wat is het eindproduct van fotosynthese?
- Opwarming van de oceaan signaleert verandering van dieet voor Europese aalscholvers
- Stiekeme mannetjes nemen vrouwelijke hersens aan om grote bruten voor de gek te houden
- Een genetische opstand in het vroege leven voorkomen
- Waar voedsel beperkt is, guppy-moeders dragen hun jongen langer
- Nieuwe slangensoort verstopt zich in het volle zicht
- Menselijk afval omzetten in plastic, voedingsstoffen kunnen helpen bij ruimtereizen over lange afstanden

- Video:Zal het cryogeen bevriezen en weer tot leven komen ooit werkelijkheid worden?

- Een moleculaire blik op ontluikende HDL-vorming

- Plastic folie die wordt gebruikt om voedsel en oppervlakken te beschermen, inactiveert het nieuwe coronavirus

- Kooldioxidereactor maakt Marsbrandstof

 Slimme machines beschermen tegen slimme aanvallen
Slimme machines beschermen tegen slimme aanvallen Goedkope waterbehandeling
Goedkope waterbehandeling Een mooie dag voor een kwantumwandeling
Een mooie dag voor een kwantumwandeling Definitie van Toxic Endpoint
Definitie van Toxic Endpoint  Nano-sized siliconen verwarming en thermometer gecombineerd om kanker te bestrijden
Nano-sized siliconen verwarming en thermometer gecombineerd om kanker te bestrijden Drie studies beschrijven verschillende delen van de ineenstorting van de Kīlauea-caldera in 2018
Drie studies beschrijven verschillende delen van de ineenstorting van de Kīlauea-caldera in 2018 Pigmenten in olieverfschilderijen in verband met degradatie van kunstwerken
Pigmenten in olieverfschilderijen in verband met degradatie van kunstwerken Supervulkanen:een sleutel tot de elektrische toekomst van Amerika?
Supervulkanen:een sleutel tot de elektrische toekomst van Amerika?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


