
Wetenschap
De structuur van ATP-synthase oplossen
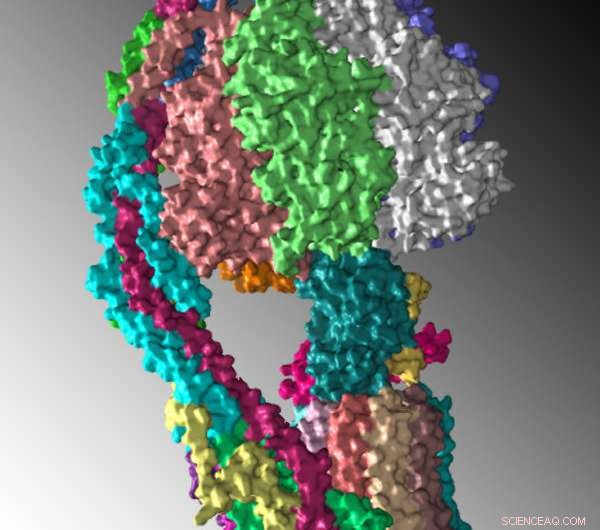
Structuur van de monomere gist ATP-synthase, weergegeven als een oppervlakteweergave, zoals bepaald door cryo-elektronenmicroscopie. Krediet:Rosalind Franklin University
Een team van wetenschappers onder leiding van Rosalind Franklin University Professor David M. Mueller, doctoraat, heeft de structuur van mitochondriaal ATP-synthase opgelost, een enzym dat ATP maakt, adenosine trifosfaat, de belangrijkste energiebron van cellen.
Gezien het belang van ATP-synthase bij het voeden van de cel, het bepalen van de volledige structuur van het enzym is een wetenschappelijke heilige graal geweest, veelbelovend om geheimen over de ATP-machine te onthullen die zouden kunnen leiden tot identificatie van therapeutische doelen en een beter begrip van metabole ziekten en andere cellulaire pathologieën.
"Om te begrijpen hoe het enzym echt werkt, is kennis nodig van zijn driedimensionale moleculaire structuur op atomair niveau, " zei dr. Mueller, hoofdonderzoeker voor de studie die cryo-elektronenmicroscopie (cryo-EM) gebruikte om het enzym te onthullen met een bijna atomaire resolutie.
De eerste volledige structuur van ATP-synthase levert bewijs voor het mechanisme waarmee het medicijn oligomycine het enzym remt en hoe ziekteverwekkende mutaties de functie van het molecuul verstoren. Het oplossen van de structuur overwint een barrière voor het begrijpen van de waarschijnlijke bredere functie ervan in ziekte- en medicijnmechanismen.
De studie, gepubliceerd door het tijdschrift Wetenschap via eerste release op 12 april, maakt de weg vrij voor het bepalen van de structuren van andere functionele toestanden van het ATP-synthase, die al tientallen jaren het onderwerp is van structurele studies in laboratoria over de hele wereld.
Dr. Müller, een onderzoeker in het Centrum voor Genetische Ziekte van de universiteit, nam een andere aanpak in samenwerking met wetenschappers van de National Institutes of Health en een team van Harvard University. Ze gebruikten cryo-EM-analyse om de gemanipuleerde ATP-synthase te ontcijferen, die werd gesynthetiseerd in gist en gereconstitueerd in nanodiscs om structurele analyse mogelijk te maken. Hoewel cryo-EM niet nieuw is, technologische vooruitgang heeft het mogelijk gemaakt om de structuur op te lossen met een bijna atomaire resolutie.
"Deze studie illustreert hoe een gecoördineerde inspanning van wetenschappers een belangrijk doel kan bereiken, "Zei Dr. Mueller. "Niemand van ons keek naar dit project vanuit ons eigen specifieke gezichtspunt. We waren gefocust op het doel zelf. Door samenwerking hebben we een probleem opgelost dat individueel, wij konden het niet."
 Nieuwe moleculaire spier reageert op zichtbaar licht
Nieuwe moleculaire spier reageert op zichtbaar licht Nieuwe stikstof-assemblage koolstofkatalysator heeft potentieel om chemische productie te transformeren
Nieuwe stikstof-assemblage koolstofkatalysator heeft potentieel om chemische productie te transformeren Veelvoorkomende toepassingen voor Magnesium Oxide
Veelvoorkomende toepassingen voor Magnesium Oxide Ultrakorte laserpulsen maken broeikasgas reactief
Ultrakorte laserpulsen maken broeikasgas reactief Chemici versnelden de reactie van vinylsulfiden 10 keer
Chemici versnelden de reactie van vinylsulfiden 10 keer
Hoofdlijnen
- Deal verbiedt val in Colorado, bureau zegt dat het toch niet wordt gebruikt (update)
- Hoe herstelt de huid?
- Door bewijzen gesteunde manieren om gefocust te blijven wanneer u studeert
- Brigitte Macron viert eerste panda geboren in Frankrijk
- Zijn kleine populieren de toekomst van biobrandstoffen? Studies zeggen ja
- Onderzoekers gebruiken het ritme van DNA-replicatie om kankercellen te doden
- Landbouwproductiviteit dreef de Euro-Amerikaanse nederzetting van Utah
- Slagen, grote oceaanreservaten moeten zowel het zeeleven als de mensen ten goede komen
- Hoe bijen hun weg naar huis vinden
- Faseovergangen leiden tot nieuwe geavanceerde materialen

- Onderzoekers helpen bij het ontwikkelen van duurzame polymeren

- Video:Hoe dubbelwerkend bakpoeder twee keer werkt

- PNNL-technologie maakt de weg vrij voor van ethanol afgeleide vliegtuigbrandstof

- Onderzoekers boeken belangrijke vooruitgang bij het printen van circuits op draagbare stoffen

 450 enorme geometrische grondwerken in de Amazone Hint naar vroegere beschavingen
450 enorme geometrische grondwerken in de Amazone Hint naar vroegere beschavingen  Wat is een reagerende variabele in wetenschappelijke projecten?
Wat is een reagerende variabele in wetenschappelijke projecten?
Wetenschappers ontwerpen experimenten om te zoeken naar oorzaak-en-gevolg relaties; waar veranderingen in één ding een voorspelbare verandering in iets anders kunnen veroorzaken. Deze
 Mark Zuckerberg en team nemen het vuur op voor massale datalek, Facebook niet goed beheerd
Mark Zuckerberg en team nemen het vuur op voor massale datalek, Facebook niet goed beheerd Waarden en gender vormen jongvolwassenen ondernemerschap en leiderschap
Waarden en gender vormen jongvolwassenen ondernemerschap en leiderschap Jack met lente hak
Jack met lente hak  De verwarming hoger zetten op afgelegen onderzoekspercelen zonder elektriciteit
De verwarming hoger zetten op afgelegen onderzoekspercelen zonder elektriciteit Om een betere halfgeleider te bouwen, identificeer eerst de gebreken
Om een betere halfgeleider te bouwen, identificeer eerst de gebreken Geologen suggereren dat Horseshoe Abyssal Plain het begin kan zijn van een subductiezone
Geologen suggereren dat Horseshoe Abyssal Plain het begin kan zijn van een subductiezone
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

