Wetenschap
Eiwitanalyse maakt nauwkeurige targeting van medicijnen mogelijk
Eiwitdoelwit Krediet:Elena Khavina/MIPT
Onderzoekers van MIPT en verschillende Amerikaanse en Chinese universiteiten hebben de structuur van een van de belangrijkste eiwitten van het zenuwstelsel opgelost in een complex met een aantal medicijnmoleculen. De ontdekking opent mogelijkheden voor het ontwikkelen van nieuwe medicijnen met gereguleerde werking en minder bijwerkingen. Het artikel is gepubliceerd in het tijdschrift Cel .
Veel moderne medicijnen richten zich op eiwitten, omdat ze verantwoordelijk zijn voor de meeste fysieke en chemische reacties in een cel. Eiwitmoleculen stellen cellen ook in staat om te communiceren door signalen tussen hen uit te zenden. Als iemand ziek wordt, de harmonie in cellen is verstoord, dus worden medicijnen gebruikt om het evenwicht te herstellen door de activiteit van eiwitten tijdelijk te verhogen of te verlagen. Velen van hen hebben vergelijkbare functies en hebben bijna identieke structuren, wat betekent dat één medicijn verschillende eiwittypen kan beïnvloeden. Dit vermogen van geneesmiddelen om te interageren met meerdere eiwitdoelen wordt polyfarmacologie genoemd.
Toen de moleculaire benadering van medicijnontwikkeling voor het eerst werd geïntroduceerd, een algemeen idee onder farmacologen was dat de werkzaamheid van geneesmiddelen afhing van de interactie van een bepaald geneesmiddel met een bepaald eiwit. De interactie met andere eiwitsoorten, echter, werd gedacht dat het alleen nadelige bijwerkingen veroorzaakte. Dus toen, het belangrijkste doel van farmacologie was om de selectiviteit te maximaliseren, dat wil zeggen, het vermogen van een medicijn om zich alleen op een specifiek type eiwitten te richten. Het concept kreeg een metaforische naam van Nobelprijswinnaar Paul Ehrlich die de term 'magische kogels' bedacht om te verwijzen naar dergelijke zeer selectieve medicijnen.
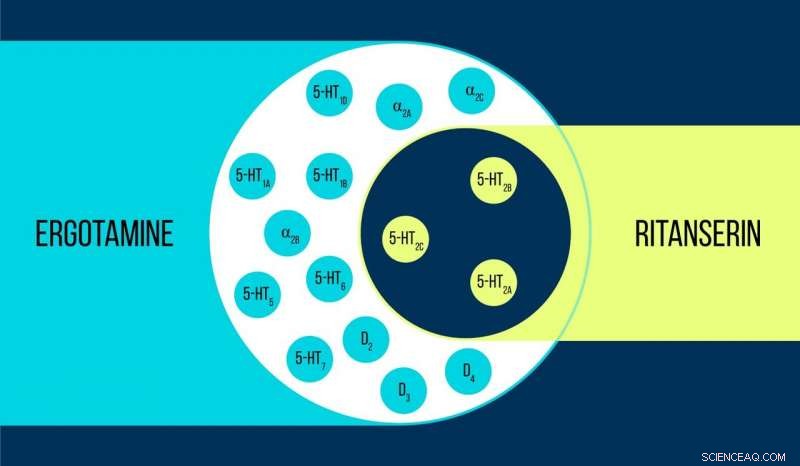
Vergelijking van ergotamine en ritanserin Krediet:Elena Khavina/MIPT
Echter, zoals vaak gebeurt, het eenvoudigste concept is niet per se het meest succesvolle. Vooruitgang in computertechnologieën in de chemie en biologie maakten het mogelijk om extreem selectieve geneesmiddelen te produceren die inwerkten op slechts twee of drie nauw verwante subtypes van een doeleiwit. Maar ze waren niet zo effectief als hun analogen met lage selectiviteit bij de behandeling van complexe aandoeningen zoals depressie:de polyfarmacologische profielen van sommige geneesmiddelen bleken belangrijk te zijn voor hun gunstige effecten. Het bleek dat polyfarmacologie niet per se nadelige bijwerkingen veroorzaakt, toch is het belangrijk om te controleren welke eiwitten worden aangetast. Het begrip "magische kogel" werd dus vervangen door het concept "magische jachtgeweer", die de nadruk legt op medicijnen met een gewenst effect op een bepaalde combinatie van doelen.
Het doel van dit onderzoek was om de structurele kenmerken van eiwitten te identificeren die zouden verklaren waarom sommige geneesmiddelen selectief op hen inwerken en andere niet. Om de studie uit te voeren, de wetenschappers gebruikten de 5-HT2c-serotoninereceptor - een signaaleiwit dat zich in het celmembraan bevindt, die wordt geactiveerd door serotonine om signalen van naburige cellen te ontvangen. De receptor heeft een aantal belangrijke kenmerken. Eerst, het wordt al gebruikt als een gevalideerd doelwit voor medicijnen tegen obesitas, terwijl het ook een potentieel therapeutisch doelwit is voor verschillende psychische stoornissen. Tweede, het is het doelwit van een aantal medicijnen met een breed scala aan selectiviteiten, waardoor het mogelijk is om ze te vergelijken. Ten derde, een menselijk lichaam heeft meer dan 800 andere receptoren die qua structuur vergelijkbaar zijn met de 5-HT2c, maar verschillende functies hebben. Dat is de reden waarom de niet-selectieve antagonisten ervan vaak een veelvoud aan bijwerkingen hebben.
Vsevolod Katritch, een gasthoogleraar aan het MIPT, zegt, "We gebruikten twee chemicaliën om met de 5-HT2c-serotoninereceptor te werken:ergotamine en ritanserine. Ergotamine is een niet-selectieve agonist met een breed polyfarmacologisch profiel:het beïnvloedt serotonine, dopamine, en adrenerge receptoren. Ritanserine, daarentegen, heeft een smaller profiel [figuur 1] en is de 5-HT2c-receptorselectieve inverse agonist. Dus, de 5-HT2c-atoomstructuren die in complex met ergotamine en ritanserine worden verkregen, helpen niet alleen de verschillen tussen actieve en inactieve receptortoestanden te verklaren - wat op zich al een aanzienlijke prestatie is - maar ook om de redenen voor dergelijke moleculaire selectiviteit te achterhalen."
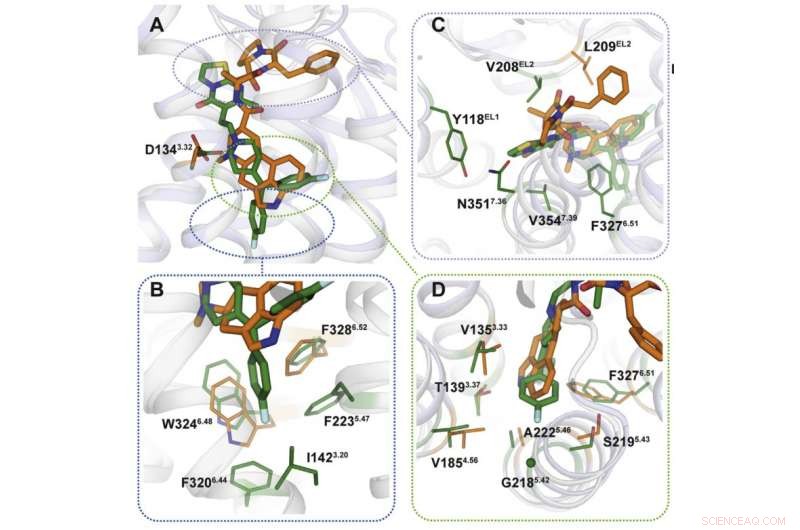
Krediet:Moskou Instituut voor Natuurkunde en Technologie
Met behulp van röntgenkristallografie, de wetenschappers verkregen een 3D-model van eiwitten op het moment van hun interactie met medicijnen. Voorspelbaar, de bindingsmechanismen van de medicijnen waren verschillend (figuur 2). De bindingsplaatsen waarop ergotamine zich richt, zijn in veel eiwitten hetzelfde, wat de niet-selectiviteit van de chemische stof verklaart. Ritanserine, anderzijds, interageert anders met de receptor en werkt alleen op enkele van zijn fragmenten die uniek zijn voor een kleine groep eiwitten. Introductie van verschillende mutaties die deze fragmenten veranderen in het 5HT2c-receptorgen, de onderzoekers merkten dat de interactie met ritanserine minder effectief werd, wat bevestigde dat die eiwitgebieden verantwoordelijk zijn voor de selectiviteit van de chemische stof.
Petr Popov, een onderzoeker bij MIPT's Laboratory of Structural Biology of G Protein-Coupled Receptors, zegt, "De belangrijkste uitdaging bij het identificeren van receptorstructuren was het verkrijgen van een stabiele, genetisch gemanipuleerde constructie die geschikt zou zijn voor kristallisatie en waarmee we zouden kunnen werken en bestuderen. Met behulp van de bio-informatische benadering en machine learning-methoden, we hebben stabiliserende puntmutaties geïdentificeerd voor de 5HT2c-receptor, zowel in actieve als inactieve toestand."
Dus, de analyse van de structurele kenmerken van eiwitten in complex met geneesmiddelen met verschillende selectiviteit bleek effectief te zijn. Het kan worden gebruikt om de reeks doelen te beheersen en dus zowel de directe als de bijwerkingen van een medicijn tijdens de ontwikkeling ervan. Ook, dergelijke geneesmiddelen zullen veel patiënten ten goede komen dankzij verbeterde therapeutische profielen die een verscheidenheid aan ziekten bestrijden en minder bijwerkingen hebben.
 Karakteriseringsstrategie helpt bij het scheiden van metaal met een hoge zuiverheid
Karakteriseringsstrategie helpt bij het scheiden van metaal met een hoge zuiverheid Onderzoekers vinden de sleutel tot het behoud van The Scream
Onderzoekers vinden de sleutel tot het behoud van The Scream Samenwerking levert ontdekking van 12-zijdige silica kooien op
Samenwerking levert ontdekking van 12-zijdige silica kooien op Hoe bacteriën een spaarvarken creëren voor de magere tijden
Hoe bacteriën een spaarvarken creëren voor de magere tijden Voedingsvezels helpen materiaal in je darmen te klonteren
Voedingsvezels helpen materiaal in je darmen te klonteren
 NASA vindt tropische storm Sergio op de rand van orkaanstatus
NASA vindt tropische storm Sergio op de rand van orkaanstatus Canarische lavaschiereiland verdubbelt in omvang omdat windverandering het risico verhoogt
Canarische lavaschiereiland verdubbelt in omvang omdat windverandering het risico verhoogt EPA trekt beleid uit het Trump-tijdperk in dat de regels voor schone lucht versoepelde
EPA trekt beleid uit het Trump-tijdperk in dat de regels voor schone lucht versoepelde Studie identificeert uitdagingen en kansen om een van de laatste bosblokken van Meso-Amerika te beschermen
Studie identificeert uitdagingen en kansen om een van de laatste bosblokken van Meso-Amerika te beschermen Wiskundige hulpmiddelen voorspellen of apparaten met golfenergie in de oceaan blijven drijven
Wiskundige hulpmiddelen voorspellen of apparaten met golfenergie in de oceaan blijven drijven
Hoofdlijnen
- Chili vecht om een favoriete mossel te redden
- De Pomodoro-techniek:je kunt elke taak 25 minuten per keer aan
- Stamcelvaccins: de nieuwe grens in kankertherapie?
- Wat zijn de verschillen van eenvoudig en gestratificeerd weefsel?
- Leeftijd van moeders beïnvloedt genetische overeenkomst tussen tweelingen
- Wat zijn de functies van mRNA & tRNA?
- Nieuwe suikerglasfilm gebruikt virussen om schadelijke bacteriën in voedsel te doden
- Onderzoeksartikelen werpen licht op een decennium lang stamcelmysterie
- Nidovirussen brengen overtollig genen tot expressie en coderen voor meer eiwitten dan eerder werd aangenomen, studie vondsten
 GM-inkomsten getroffen door kosten Zuid-Korea
GM-inkomsten getroffen door kosten Zuid-Korea De satelliet aan de rand van de ruimte
De satelliet aan de rand van de ruimte Met Google kun je muziek over zijn slimme luidsprekers verplaatsen met de functie Stream Transfer
Met Google kun je muziek over zijn slimme luidsprekers verplaatsen met de functie Stream Transfer Wetenschappers leggen het koude hart bloot van aan land vallende orkanen
Wetenschappers leggen het koude hart bloot van aan land vallende orkanen Philly-raffinaderij plant een fabriek van $ 120 miljoen om voedselresten om te zetten in brandstof voor vrachtwagens en bussen
Philly-raffinaderij plant een fabriek van $ 120 miljoen om voedselresten om te zetten in brandstof voor vrachtwagens en bussen Forensische wetenschapsprojecten voor middelbare scholieren
Forensische wetenschapsprojecten voor middelbare scholieren VN dringt er bij Facebook op aan om haatzaaiende uitlatingen proactief te bestrijden
VN dringt er bij Facebook op aan om haatzaaiende uitlatingen proactief te bestrijden Michelangelo-gebouwen
Michelangelo-gebouwen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com