
Wetenschap
Zeer efficiënte ammoniaksynthesekatalysator ontwikkeld
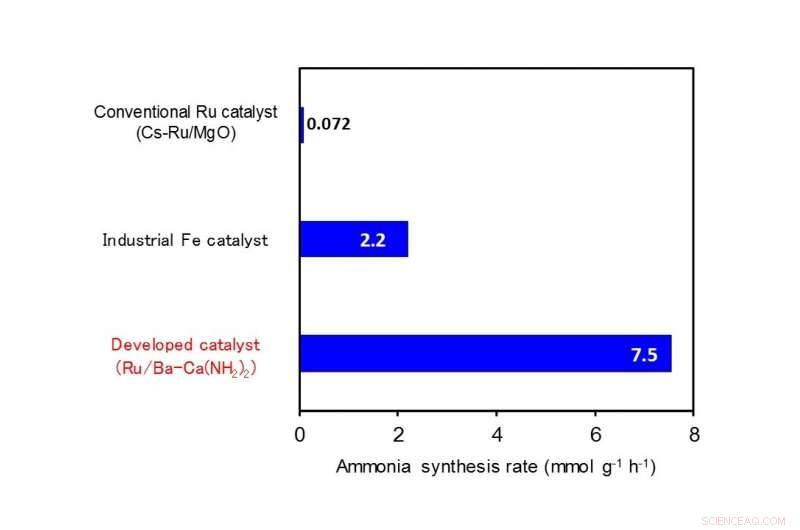
Vergelijking van ammoniaksynthese-activiteit (reactietemperatuur 260ºC, druk 9 atm). Credit: Angewandte Chemie
Onderzoekers van het Tokyo Institute of Technology (Tokyo Tech) hebben ontdekt dat een katalysator van calciumamide met een kleine hoeveelheid toegevoegd barium (Ba-Ca(NH 2 ) 2 ) met ruthenium-nanodeeltjes erop geïmmobiliseerd, kan ammoniak synthetiseren met een efficiëntie die 100 keer groter is dan die van conventionele rutheniumkatalysatoren bij lage temperaturen onder 300ºC. De prestatie van deze katalysator is ook vele malen hoger in vergelijking met ijzerkatalysatoren die momenteel industrieel worden gebruikt.
Ammoniak is een grondstof voor stikstofmeststoffen en is een sleutel tot voedselproductie. Een ammoniakmolecuul is één stikstofatoom gebonden met drie waterstofatomen. Als resultaat, ammoniak is een stof met een zeer hoog waterstofgehalte voor zijn massa. Omdat het bij kamertemperatuur bij een druk van 10 atmosfeer vloeibaar wordt, het is ook een energiedrager voor waterstof, de energiebron voor technologieën zoals brandstofcellen.
Het Haber-Bosch-proces, de huidige industriële ammoniaksynthesemethode (opgericht in 1913) maakt gebruik van een katalysator die voornamelijk uit ijzer bestaat en vereist hoge temperaturen (400 tot 500ºC) en hoge drukken (100 tot 300 atm). Om aan deze voorwaarden te voldoen, ammoniak wordt geproduceerd in grote, speciale fabrieken en vervolgens getransporteerd naar fabrieken waar het wordt gebruikt voor industriële processen. Er is al lang vraag naar productie ter plaatse waarbij de benodigde hoeveelheid ammoniak kan worden gesynthetiseerd waar het nodig is, in tegenstelling tot het conventionele grootschalige proces.
De Tokyo Tech onderzoeksgroep van professor Hideo Hosono, Professor Michikazu Hara, Universitair hoofddocent Masaaki Kitano en anderen ontdekten een ammoniaksynthesekatalysator die zeer efficiënt werkt bij lage temperaturen. Ze ontdekten dat een katalysator van calciumamide met een kleine hoeveelheid toegevoegd barium (Ba-Ca(NH .) 2 ) 2 ) met ruthenium-nanodeeltjes erop geïmmobiliseerd, vertoont bij lage temperaturen onder 300ºC een katalytische activiteit die 100 keer groter is dan die van conventionele rutheniumkatalysatoren. Verder, de katalytische prestatie van deze katalysator is ook meerdere malen hoger in vergelijking met ijzerkatalysatoren die industrieel worden gebruikt (Figuur 1).
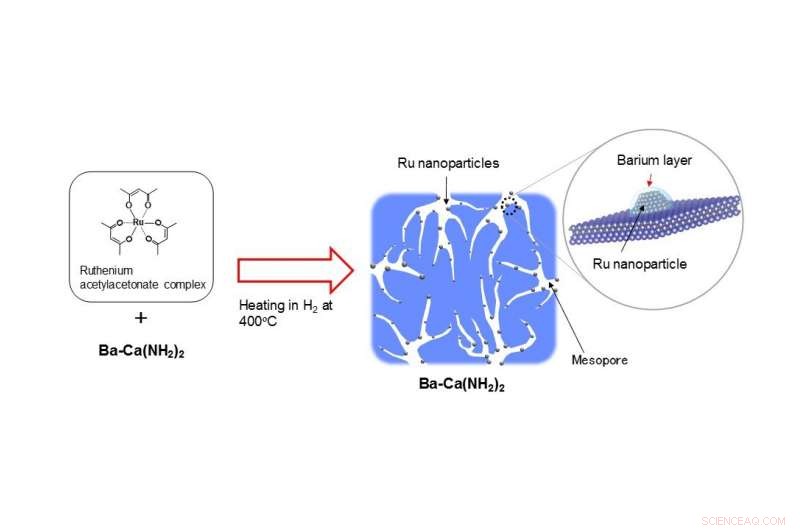
De actieve structuur van ontwikkelde katalysator (Ru/Ba-ca(NH2)2) Krediet: Angewandte Chemie
Als grondstof voor ruthenium wordt een rutheniumacetylacetonaatcomplex gebruikt. Door verhitting van een poeder gemengd met Ba-Ca(NH .) 2 ) 2 tot 400ºC in een waterstofatmosfeer, een dunne bariumlaag wordt gevormd op ruthenium-nanodeeltjes van ongeveer 3 nm groot, omdat tegelijkertijd poreus calciumamide wordt gevormd (Figuur 2). De oppervlakte van Ba-Ca(NH 2 ) 2 , de grondstof voor de katalysator, is slechts ongeveer 17 m 2 /G. Echter, aangezien de katalysator poreus wordt bij verhitting tot 400ºC in waterstof met de rutheniumbron, de groep ontdekte dat het oppervlak uitbreidt tot ongeveer 100 m 2 /G. Verder, het aan het calciumamide toegevoegde bariumbestanddeel verplaatst zich tijdens deze warmtebehandeling naar het oppervlak van de katalysator en vormt een dunne laag door de ruthenium-nanodeeltjes te bedekken. De groep ontdekte dat dit een unieke katalysator is, waarbij dergelijke actieve structuren zich op een zelfgeorganiseerde manier vormen en gedurende de reactie stabiel blijven. De in dit onderzoek ontwikkelde katalysator vertoont de hoogste ammoniaksyntheseactiviteit bij lage temperaturen van alle vaste katalysatoren die de afgelopen jaren zijn gerapporteerd.
De katalysator die in dit onderzoek is ontwikkeld, overtreft ver de grenzen van bestaande katalytische materialen wat betreft zijn ammoniaksynthese-activiteit en zal aanzienlijk bijdragen aan het verminderen van de energie die wordt gebruikt voor het ammoniaksyntheseproces. Daarom, de verdere ontwikkeling van deze technologie zal naar verwachting leiden tot een nieuwe processtructuur voor on-site synthese van ammoniak.
 Dimethicone Vs. Silicone
Dimethicone Vs. Silicone Wetenschappers ontwikkelen een veilige, goedkope technologie voor desinfectie van verpakte eieren
Wetenschappers ontwikkelen een veilige, goedkope technologie voor desinfectie van verpakte eieren Waterdamp uit uw mond laten komen
Waterdamp uit uw mond laten komen Het wateroppervlak is een fantastische plek voor chemische reacties
Het wateroppervlak is een fantastische plek voor chemische reacties Wiskundig model van thermoplastisch composiet helpt bij het ontwerpen en certificeren van zeer betrouwbare constructies
Wiskundig model van thermoplastisch composiet helpt bij het ontwerpen en certificeren van zeer betrouwbare constructies
 Een nieuwe kijk op afvalwaterrecycling in Zuid-Korea
Een nieuwe kijk op afvalwaterrecycling in Zuid-Korea Niet-levende dingen die groeien
Niet-levende dingen die groeien India zou kunnen voldoen aan de luchtkwaliteitsnormen door het brandstofverbruik van huishoudens te verminderen
India zou kunnen voldoen aan de luchtkwaliteitsnormen door het brandstofverbruik van huishoudens te verminderen Nieuwe groenere en efficiëntere geluidsschermen
Nieuwe groenere en efficiëntere geluidsschermen Himalaya-gletsjerramp wijst op risico's van klimaatverandering
Himalaya-gletsjerramp wijst op risico's van klimaatverandering
Hoofdlijnen
- Slimme app gebruikt smartphonecamera om plantensoorten te identificeren
- Onderzoekers observeren enzymen die cellulose afbreken om de productie van biobrandstoffen te ondersteunen
- Nieuwe kaarten laten zien dat de krimpende wildernis op eigen risico wordt genegeerd
- Soorten redeneren in geometrie
- Productietijden kunnen het illegaal witwassen van wilde dieren tegengaan
- Nieuwe studie laat zien hoe vogels samenwerken om samen te zingen
- Differentiërende RNA & DNA-virussen
- Door geplande experimenten online te volgen, kunnen manieren worden gevonden om dierproeven te verbeteren
- Veel vis in de zee? Niet noodzakelijk, zoals de geschiedenis laat zien
 Voor het eerst in 5 jaar, Amerikaanse benzineverbruik gedaald, uitstoot omhoog
Voor het eerst in 5 jaar, Amerikaanse benzineverbruik gedaald, uitstoot omhoog Sub maakt snelle stijging in Indische Oceaan; bemanning veilig
Sub maakt snelle stijging in Indische Oceaan; bemanning veilig Aurorale knetterende geluiden zijn gerelateerd aan de elektromagnetische resonanties van de aarde
Aurorale knetterende geluiden zijn gerelateerd aan de elektromagnetische resonanties van de aarde Soorten monomeren
Soorten monomeren Traditionele eutectische legering biedt nieuwe hoop voor metaal-zuurstofbatterijen met hoge energiedichtheid
Traditionele eutectische legering biedt nieuwe hoop voor metaal-zuurstofbatterijen met hoge energiedichtheid Laserstraalvorming gebruiken om 3D-printen van metaal te verbeteren
Laserstraalvorming gebruiken om 3D-printen van metaal te verbeteren Geladen grafeen geeft DNA een podium om moleculaire gymnastiek uit te voeren
Geladen grafeen geeft DNA een podium om moleculaire gymnastiek uit te voeren Omhulsels drijven krachtige nieuwe kunstmatige spieren aan
Omhulsels drijven krachtige nieuwe kunstmatige spieren aan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






