
Wetenschap
Een 3D-aanpak om kanker te stoppen
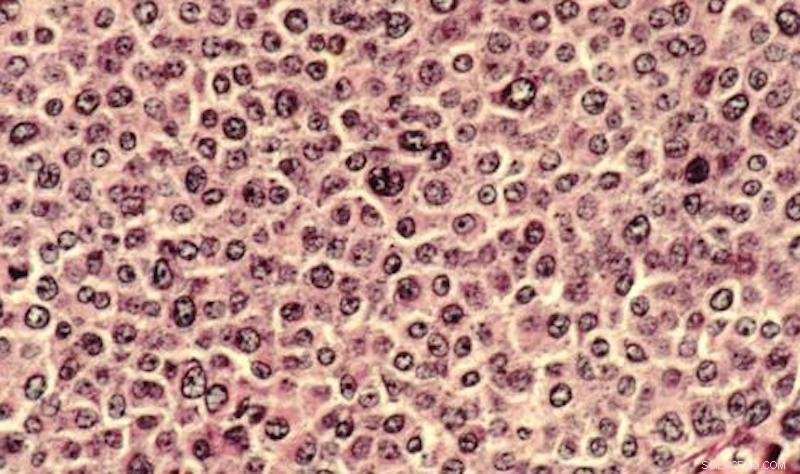
Kankercellen worden traditioneel bestudeerd in petrischalen en op objectglaasjes. Onderzoekers hebben nu een 3D-model ontwikkeld om de complexiteit van kankercellen te analyseren in een omgeving die het menselijk lichaam beter nabootst. Krediet:Dr. Cecil Fox, Publiek domein
Elke dag, in het menselijk lichaam worden ongeveer 100 miljard nieuwe cellen aangemaakt. Deze cellen voegen zich bij biljoenen oudere cellen om de weefsels en organen te vormen waarop we vertrouwen om in leven te blijven. Soms, wanneer een cel wordt gemaakt, er vindt een mutatie plaats in het DNA, de cel transformeren in iets dat defect is en potentieel gevaarlijk is voor de interne omgeving van het lichaam. Gebruikelijk, een cel zal zijn eigen defecten herkennen en zichzelf snel beëindigen.
Maar soms, in plaats van zichzelf te elimineren, de gemuteerde cel repliceert, een tumor vormen die uit elkaar kan vallen, metastaseren (d.w.z. migreren), en andere delen van het lichaam binnendringen, vaak via de bloedbaan. Gelukkig, Carnegie Mellon University's hoogleraar Werktuigbouwkunde Philip LeDuc, in samenwerking met Ph.D. student James Li Wan en Dr. Carola Neumann, een borstkankeronderzoeker van de Universiteit van Pittsburgh, een patiëntgericht model ontwikkeld dat wetenschappers kunnen gebruiken om de migratie van kankercellen beter te begrijpen en uiteindelijk te stoppen.
Volgens LeDuc, dit project begon vanwege de groeiende interesse die onderzoekers hebben getoond in de relatie tussen natuurwetenschap en kanker. Omdat tumoren eigenlijk fysiek massa, beide biochemisch en fysieke middelen kunnen kankercellen en tumoren aantasten. Na het verband tussen deze twee onderwerpen te hebben overwogen, LeDuc, Neumann, en Wan richtten hun aandacht op metastase en kankercelanalyse. Door hun samenwerking, ze waren in staat om een nauwkeurigere en relevantere manier te ontwikkelen om kankercellen te bestuderen.
Hoewel celanalyse traditioneel plaatsvindt in een plastic petrischaaltje, het onderzoeksteam creëerde een 3D-model dat nauwkeuriger de fysiologische omstandigheden van een organisme weerspiegelt. Met dit model, wetenschappers kunnen de complexiteit van kankercellen blootleggen en analyseren in een omgeving die het menselijk lichaam beter nabootst.
"Biologie is bestudeerd door decennia lang cellen in petrischalen te plaatsen, " zegt LeDuc. "Maar de vraag is, kun je systemen maken die fysiologisch relevanter zijn? We gebruiken microfluïdische en microfabricagebenaderingen om driedimensionale systemen te creëren, omdat cellen in driedimensionale weefsels bestaan - ze bevinden zich niet van nature in een 2D-petrischaal."
Typisch, microfluïdische systemen - systemen die vloeistoffen op microscopisch niveau overbrengen - zijn gemaakt van plastic, maar sinds LeDuc, Neumann, en Wan waren op zoek naar een meer fysiologisch relevant systeem, ze creëerden hun microfluïdische systeem met behulp van collageen, het meest overheersende eiwit in het menselijk lichaam.
"Zoals Phil zei, we kweken traditioneel cellen in plastic en werken ermee in petrischalen, " zegt Neumann, een universitair hoofddocent farmacologie en chemische biologie aan de Universiteit van Pittsburgh. "Maar nergens in je lichaam heb je plastic. Het hebben van een 3D-systeem dat fysiologische omstandigheden nabootst, is een veel betere manier om snellere en relevantere resultaten te krijgen."
Elk microfluïdisch apparaat dat door het team is gemaakt, bevat twee belangrijke componenten:een reeks parallelle kanalen die traditionele bloedvaten nabootsen en een concentratie van kankercellen die zijn ingebed in het collageen.
Als een apparaat eenmaal is gebouwd, de kanalen worden geïnjecteerd met een chemisch stimulerend middel dat diffundeert in het omringende collageen. Naarmate moleculen van het stimulerende middel verder van de kanalen af bewegen, er ontstaat een biomoleculaire gradiënt. Deze gradiënt zorgt ervoor dat de ingebedde kankercellen bewegen - vaak terug naar de gesimuleerde bloedvatkanalen.
Bij een patiënt, als kankercellen in de bloedbaan terechtkomen, ze metastaseren en kunnen secundaire kankertumoren vormen. Volgens LeDuc en Neumann, de meeste patiënten met solide tumoren sterven meestal aan metastase - niet aan de primaire tumor zelf - en daarom moeten wetenschappers erachter komen hoe ze kunnen voorkomen dat metastase optreedt.
Metastaserende kankercellen hebben het vermogen gekregen om van de primaire tumor naar het bloed- of lymfesysteem te gaan - een proces waarbij kankercellen moeten migreren en het tumorweefsel moeten hermodelleren om andere delen van het lichaam binnen te dringen. Dus, om metastase te stoppen, wetenschappers moeten begrijpen welke factoren de mobiliteit van kankercellen en weefselremodellering ondersteunen. Daarom is het door LeDuc ontwikkelde 3D-systeem Neumann, en Wan is zo belangrijk.
"Kanker is een extreem heterogene ziekte, wat betekent dat niet alleen kankercellen van patiënt tot patiënt verschillen, ze variëren zelfs binnen één tumor, " zegt Neumann. "Hetzelfde geldt voor metastasen. Afhankelijk van hun locatie in het lichaam, elke extra secundaire tumor is ook anders."
Om de beste behandeling voor elke patiënt te bepalen, LeDuc, Neumann, en Wan geloven dat onderzoekers hun systeem uiteindelijk zullen kunnen gebruiken om tumoren van individuele kankerpatiënten te onderzoeken. Dit proces zou uiteindelijk helpen om de behandeling van kanker persoonlijker en effectiever te maken.
"Ons model zou mogelijk kunnen dienen als een patiëntspecifiek model, " zegt Wan, die de laboratoriumexperimenten uitvoerde en de resultaten voor dit onderzoek analyseerde. "En dat is heel belangrijk omdat kanker bij elke patiënt anders is, waardoor het moeilijk te genezen is."
Ideaal, het door LeDuc ontwikkelde 3D-systeem, Neumann, en Wan zal onderzoekers en wetenschappers de tools geven die ze nodig hebben om te voorkomen dat kankercellen bij elke patiënt uitzaaien.
"Aan het einde van de dag, de tumor die daar zit en niets doet - dat is oké, " zegt LeDuc. "Maar zodra het uitgezaaid is, alles breekt los. We hopen dat ons systeem zal helpen om metastase te stoppen en de patiëntresultaten op de lange termijn te verbeteren."
Het onderzoeksrapport van het team, getiteld "Het nabootsen van ingebedde vasculatuurstructuur voor 3D-kanker op een chip-benaderingen door middel van microfrezen, " werd gepubliceerd in Wetenschappelijke rapporten . Naast Philip LeDuc, Carola Neumann, en James Li Wan, werktuigbouwkunde Ph.D. student Jonelle Yu, werktuigbouwkunde Professor Burak Ozdoganlar (Carnegie Mellon University), en postdoctoraal onderzoeker Dr. John Skoko (Universiteit van Pittsburgh) droegen bij aan deze studie.
 Katalysatoromschakeling betekent dat vier één worden
Katalysatoromschakeling betekent dat vier één worden Welke van de volgende gassen zou het meest gedragen als een ideaal gas: hij, NH3, Cl2 of CO2?
Welke van de volgende gassen zou het meest gedragen als een ideaal gas: hij, NH3, Cl2 of CO2?  Wat is de chemische formule van bleekmiddel?
Wat is de chemische formule van bleekmiddel?
Bleach is de algemene term voor stoffen die vlekken oxideren of "bleken". Er zijn een aantal in de handel verkrijgbare bleekverbindingen. Ze worden allemaal gebruikt om het wasgoed te ontsmetten en op te
 Cantharelpaddestoelen als smaakversterker
Cantharelpaddestoelen als smaakversterker Nieuwe synthetische methode voor waterstabiele perovskieten
Nieuwe synthetische methode voor waterstabiele perovskieten
 NASA ziet vorming van tropische cycloon Caleb bij Cocos Island
NASA ziet vorming van tropische cycloon Caleb bij Cocos Island Trash tracking-satellieten helpen Indonesië om afval in zee aan te pakken
Trash tracking-satellieten helpen Indonesië om afval in zee aan te pakken Gefossiliseerde boom en ijskernen helpen bij het dateren van enorme vulkaanuitbarsting 1, 000 jaar geleden tot binnen drie maanden
Gefossiliseerde boom en ijskernen helpen bij het dateren van enorme vulkaanuitbarsting 1, 000 jaar geleden tot binnen drie maanden Gebruik van bomen
Gebruik van bomen  Atmosferische waterdamp in de stad Tel Aviv is geschikt om te drinken
Atmosferische waterdamp in de stad Tel Aviv is geschikt om te drinken
Hoofdlijnen
- Nieuwe soorten ontdekt in Maleisisch regenwoud tijdens ongekende, onderzoek van boven naar beneden
- Hoe cellen tellen met een microscoop
- E. Coli kweken in een petrischaal
- Hoe doodt alcohol bacteriën?
- mRNA: definitie, functie en structuur
- Levenslange bloedproductie is afhankelijk van honderden cellen die zich vóór de geboorte vormen
- Zijn mensen echt afstammelingen van apen?
- De nadelen van biotechnologie
- Er zit een diepere vis in de zee
- Kunstmatige cellen reageren op veranderingen in de omgeving
- Onderzoekers ontwikkelen sensoren die menselijke biomarkers en giftig gas detecteren
- Eerste contact tussen malaria en mens in kaart gebracht met Nobelprijswinnende technologie
- Strategieën om grotere poriën te genereren in metaal-organische raamwerken
- Onderzoek naar biomimicry - het bouwen van de volgende generatie aanpasbare materialen uit de natuur

 Pijlers op nanoschaal kunnen de omzetting van warmte in elektriciteit radicaal verbeteren
Pijlers op nanoschaal kunnen de omzetting van warmte in elektriciteit radicaal verbeteren Hoe dieren te fokken voor Profit
Hoe dieren te fokken voor Profit Onderzoekers boeken vooruitgang in groene chemie met nieuwe katalysator voor reductie van koolstofdioxide
Onderzoekers boeken vooruitgang in groene chemie met nieuwe katalysator voor reductie van koolstofdioxide Een 26-jarige miljardair bouwt virtuele grensmuren - en de federale overheid koopt
Een 26-jarige miljardair bouwt virtuele grensmuren - en de federale overheid koopt Wat doet zalm eten?
Wat doet zalm eten?  Nieuwe katalysator maakt van ammoniak een innovatieve schone brandstof
Nieuwe katalysator maakt van ammoniak een innovatieve schone brandstof lawines, een bergbedreiging
lawines, een bergbedreiging Kwantummechanica laat de olie-industrie de belofte van herstelexperimenten weten voordat ze beginnen
Kwantummechanica laat de olie-industrie de belofte van herstelexperimenten weten voordat ze beginnen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

