
Wetenschap
Nieuw model onthult mogelijkheid om antibiotica in bacteriën te pompen
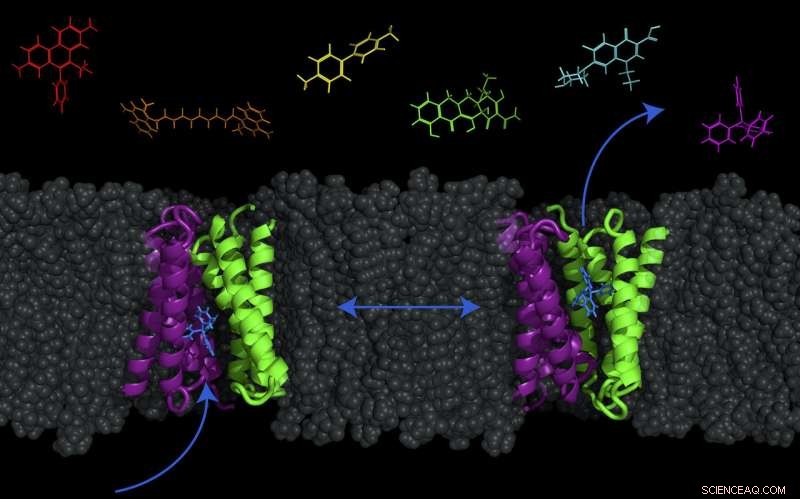
Een transporteiwit -- EmrE genaamd, weergegeven in paars en groen -- in het celmembraan van E. coli bacteriën kunnen worden omgeschakeld tussen twee conformaties om moleculen (zoals antibacteriële geneesmiddelen) uit of in de cel te pompen. Krediet:Katherine Henzler-Wildman/UW-Madison.
Onderzoekers van de afdeling Biochemie van de Universiteit van Wisconsin-Madison hebben ontdekt dat een cellulaire pomp waarvan bekend is dat hij medicijnen zoals antibiotica uit E. coli-bacteriën haalt, het potentieel heeft om ze ook binnen te halen, nieuwe onderzoekslijnen openen naar de bestrijding van de bacterie.
De ontdekking zou bijna 50 jaar denken over hoe dit soort transporteurs in de cel functioneren, kunnen herschrijven.
Cellen moeten verschillende materialen aan- en afvoeren om te overleven. Om dit te bereiken, ze gebruiken verschillende transporteiwitten in hun celmembranen, waarvan de meeste worden aangedreven door wat de proton-aandrijfkracht wordt genoemd. De proton-aandrijfkracht is gericht op de binnenkant van de cel in bacteriën, wat betekent dat protonen van nature van buitenaf de cel binnen willen komen en dat doen als er een weg voor hen is. Deze transporters maken de gemeten beweging van protonen in de cel mogelijk - en in ruil voor protonen die naar binnen gaan, geneesmiddelmoleculen worden verdreven.
Lange tijd werd gedacht dat deze gekoppelde uitwisseling van protonen (in) en drugs (uit) door de transporteur zeer strikt was. Echter, in een vandaag gepubliceerde studie (7 november, 2017) in het tijdschrift Proceedings van de National Academy of Sciences , UW-Madison biochemieprofessor Katherine Henzler-Wildman en medewerkers van de Washington University School of Medicine in St. Louis hebben ontdekt dat voor E. coli's kleine multidrug-resistentietransporter, genaamd EmrE, proton- en drugsbewegingen zijn niet zo strikt gekoppeld. Deze transporter kan in feite ook medicijnen en protonen in dezelfde richting over het membraan verplaatsen, evenals de tegenovergestelde richting - de introductie van de mogelijkheid om moleculen zowel in als uit de cel te verplaatsen.
Dit kleine detail heeft grote gevolgen, zeggen de onderzoekers. De modellen die wetenschappers al bijna 50 jaar gebruiken om te visualiseren hoe deze transporteurs werken, houden geen rekening met de nieuwe gegevens. Het betekent ook dat het mogelijk is dat medicijnen de cel in worden gepompt.
"De implicaties op de lange termijn zijn dat deze multi-drug transporter omkeerbaar is, "zegt Henzler-Wildman. "Dus in plaats van medicijnen naar buiten te pompen om resistentie te verlenen, je hebt de mogelijkheid dat je het zou kunnen gebruiken om medicijnen in te pompen om bacteriën te doden. Drugstoetreding is een groot probleem, dus dit is een nieuw gebied om te verkennen."

Biochemie professor Henzler-Wildman in de National Magnetic Resonance Facility in Madison, gehuisvest in de afdeling biochemie van UW-Madison. Krediet:UW-Madison/Robin Davies
Ze voegt eraan toe dat deze studie en haar eerdere werk suggereren dat door het manipuleren van de omgevingsomstandigheden of het medicijn zelf, de onderzoekers kunnen mogelijk niet alleen de snelheid van het transport regelen, maar ook de richting ervan - althans in reageerbuizen in het laboratorium. Dit proberen te bevestigen bij bacteriën is een van de volgende stappen in hun onderzoek, ze zegt.
"We begonnen met een heel fundamentele wetenschappelijke vraag:'hoe werken deze transporteurs?' en zijn op deze werkelijk translationele richting gestuit, " zegt ze. "Mensen hebben geprobeerd dit soort pompen als doelwit te gebruiken om antibioticaresistentie te stoppen om antibiotica die we al hebben weer effectief te maken. Dit suggereert dat je het misschien niet alleen kunt stoppen, maar deze pompen ook daadwerkelijk kunt gebruiken om medicijnen de cel in te drijven als een nieuw mechanisme voor het binnendringen van medicijnen."
Deze specifieke transporter wordt in veel bacteriën aangetroffen. Verrassend genoeg, wetenschappers weten nog niet wat de echte functie in de cel is. Hoewel het antibiotica pompt, het is niet de belangrijkste transporter die E. coli helpt bij antibioticaresistentie, en het is mogelijk dat het andere doeleinden heeft die nog niet zijn ontdekt. Ze hebben alleen ontdekt dat het een groot aantal moleculen van kleurstoffen naar antibiotica transporteert.
"Bacteriën zijn voortdurend in oorlog met elkaar, dus misschien speelt het wel een rol bij resistentie tegen medicijnen, "zegt Henzler-Wildman. "Maar het kan ook iets anders vervoeren dat we niet hebben getest, of misschien werkt het in pH-resistentie. We hebben het nog niet verkleind."
traditioneel, het model dat werd gebruikt om deze transporter te beschrijven was het "pure-exchange model, " die de strikte, gereguleerde beweging van protonen en het medicijn in tegengestelde richtingen. Echter, de realiteit van dit proces volgt de mantra van 'het leven is rommelig'.
Henzler-Wildman stelt een nieuw model voor, het "free-exchange model", " waar de combinaties en transportrichting veel flexibeler zijn met veel meer opties dan eerder werd gedacht. Ze gebruikten magnetische resonantiegegevens om deze specifieke en voorheen onbekende bewegingen van de transporter te visualiseren. Vervolgens onderzochten ze hoe de transporter precies reageert in de reageerbuis wanneer , bijvoorbeeld, het wordt blootgesteld aan antibiotica, om te bevestigen dat het werkt zoals de structuren hebben laten zien.
"Als we het model moeten herwerken en in wezen het leerboek moeten herschrijven over wat we wisten over de transporteurs, zal de manier waarop we denken echt veranderen. "zegt ze. "Ik ga deze paper eigenlijk geven in onze intro-afstudeercursus omdat het zo'n goed verhaal is over hoe het hebben van een model in je hoofd je denken en experimenten kan beperken en je echt belangrijke dingen mist."
 Nieuwe manier om naar celmembranen te kijken, kan de manier veranderen waarop we ziekten bestuderen
Nieuwe manier om naar celmembranen te kijken, kan de manier veranderen waarop we ziekten bestuderen Chemische innovatie stabiliseert de best presterende perovskietformulering
Chemische innovatie stabiliseert de best presterende perovskietformulering Een onderzoeksteam ontwikkelt biotransistoren die de kleinste signalen kunnen detecteren
Een onderzoeksteam ontwikkelt biotransistoren die de kleinste signalen kunnen detecteren Atomair nauwkeurige modellen verbeteren het begrip van brandstofcellen
Atomair nauwkeurige modellen verbeteren het begrip van brandstofcellen Voorbeelden van niet-mengbare vloeistoffen
Voorbeelden van niet-mengbare vloeistoffen
 Pitt-onderzoekers rapporteren push voor regionale groene infrastructuurdatabase
Pitt-onderzoekers rapporteren push voor regionale groene infrastructuurdatabase IJzercarbonaten in de aardmantel helpen bij het vormen van diamanten
IJzercarbonaten in de aardmantel helpen bij het vormen van diamanten Portugal voert strijd op tegen de verspreiding van bosbranden in de Algarve
Portugal voert strijd op tegen de verspreiding van bosbranden in de Algarve Evaluatie van de rehabilitatie van een oude mijnafvalsteenhoop
Evaluatie van de rehabilitatie van een oude mijnafvalsteenhoop Opruimduiken, recycling:Libanezen reageren op afvalcrisis
Opruimduiken, recycling:Libanezen reageren op afvalcrisis
Hoofdlijnen
- Manitobas goudvleugelzangers:'s werelds laatste pure populatie die wordt geraakt door lokale en verre instandhoudingsproblemen
- Mensen evolueren nog steeds - Heres the Evidence
- Een vogel in de bush is $223 waard, 851 in de hand
- Waarom DNA de meest gunstige molecule is voor genetisch materiaal en hoe RNA zich hiermee verhoudt
- Veldonderzoek heeft tot doel de verspreiding van door teken overgedragen ziekten in het Midwesten te vertragen
- Wat is het voordeel van het feit dat het DNA goed is ingepakt in de chromosomen?
- Wilde dieren vormen grote bedreiging voor Outback, klimaatverandering studie vindt
- Heeft een virus DNA?
- De rol van de longen
 Vrouwelijke leiders krijgen minder vaak steun dan mannen na grote terroristische aanslagen
Vrouwelijke leiders krijgen minder vaak steun dan mannen na grote terroristische aanslagen Grondwateronderzoeken kunnen worden aangetast door vooringenomenheid van overlevenden
Grondwateronderzoeken kunnen worden aangetast door vooringenomenheid van overlevenden Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om wetshandhaving bij misdrijven te ondersteunen?
Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om wetshandhaving bij misdrijven te ondersteunen?  Onderzoek toont de robuuste opslag van qubits in ultrakoude polaire moleculen aan
Onderzoek toont de robuuste opslag van qubits in ultrakoude polaire moleculen aan Als de machines komen voor banen bij de overheid, zal efficiëntie het eigen vermogen verpletteren?
Als de machines komen voor banen bij de overheid, zal efficiëntie het eigen vermogen verpletteren? Het gewicht van verplaatst water berekenen
Het gewicht van verplaatst water berekenen Ophoping van plastic in diepzee door troebelheidsstromen:NW Zuid-Chinese zee
Ophoping van plastic in diepzee door troebelheidsstromen:NW Zuid-Chinese zee Cijfercijfers berekenen
Cijfercijfers berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






