
Wetenschap
Dynamiek van massa-actie in niet-stabiele toestand heroverwogen
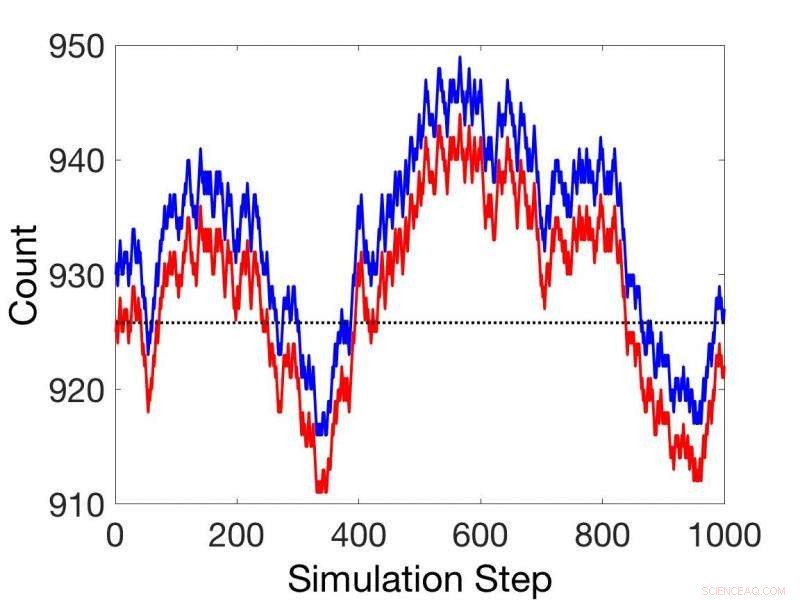
Vergelijkingen tussen niet-stationaire stochastische kinetische simulaties (rood) en simulaties met behulp van de gekoppelde reactiestelling (blauw). Krediet:Pacific Northwest National Laboratory
De wet van massale actie werd 150 jaar geleden voor het eerst beschreven. Vandaag, het is nog steeds een vast begrip in elke eerstejaars scheikundetekst. De wet stelt dat de snelheid van een chemische reactie evenredig is met de concentratie van de reactanten. Voor oplossingen in dynamisch evenwicht, de wet voorspelt hoe die oplossingen zich zullen gedragen.
Maar het is een uitdaging om de wet van massale actie toe te passen op complexe systemen, zoals biologische stofwisseling. Voor een, de meeste snelheidsconstanten zijn niet beschikbaar, en het meten van de ontbrekende is zeer arbeidsintensief.
Bij biologisch onderzoek het meten van snelheidsconstanten vereist het isoleren en zuiveren van individuele enzymen, vervolgens de snelheidsconstanten bepalen met spectrofotometrie - dat wil zeggen, door hoeveel licht een chemische stof absorbeert. Dit vertraagt de doorvoersnelheid, waardoor het moeilijk is om elk nieuw genoom te karakteriseren. Ten slotte, om dit te doen zijn duizenden snelheidsparameters nodig.
Vanwege deze problemen, een groot aantal enzymsnelheidsparameters zijn bepaald voor slechts enkele goed beschreven systemen, zoals Escherichia coli. Voor de meeste biologische systemen wetenschappers hebben nog geen snelheidsconstanten verkregen.
In de tussentijd, de voorkeursmethode voor het modelleren van grootschalige biologische processen (zoals metabolisme) omvat op beperkingen gebaseerde fluxmodellen. Maar deze modellen lijden aan een gebrek aan fysica met betrekking tot de wet van massale actie, beperking van het vermogen van op beperkingen gebaseerde benaderingen, zelfs wanneer ze worden uitgebreid met thermodynamica en andere factoren.
als antwoord, sommige onderzoekers hebben voorgesteld om elementaire reacties te bestuderen met behulp van de wet van massareactie door reactie-affiniteiten in plaats van snelheidsconstanten.
Een nieuw artikel in het tijdschrift Fysische Biologie door William R. Cannon en Scott E. Baker van het Pacific Northwest National Laboratory beoordeelt de relatie tussen reactieaffiniteit en vrije energie voor geïsoleerde reacties met behulp van concepten uit statistische thermodynamische integratie. Cannon en Baker wilden expliciet de relatie aantonen tussen kinetische formuleringen van snelheden die snelheidsconstanten gebruiken en een statistische thermodynamische formulering die chemische potentialen gebruikt.
Vervolgens presenteren ze een stelling voor gekoppelde reacties op basis van chemische potentialen, die relatieve snelheden kan bieden voor alle sequentieel gekoppelde reacties onder alle omstandigheden, stabiele toestand of niet. Dit vermijdt de noodzaak voor snelheidsconstanten in veel toepassingen.
Het gebruik van chemische potentialen in plaats van snelheidsconstanten vertegenwoordigt een methodologische sprong die volgens de auteurs een belangrijke vooruitgang zou kunnen betekenen voor voorspellende modellering in systeembiologie.
De nieuwe methode maakt complexe, grootschalige biologische systemen zoals metabolisme te modelleren met kinetiek en thermodynamica. Dit zal resulteren in nauwkeurigere voorspellingen voor het ontwerp van micro-organismen om zich op de gewenste manieren te gedragen, zoals die welke kunnen worden gebruikt om biobrandstoffen te produceren.
Bovendien, de auteurs zeggen, de nieuwe methode zal fundamenteel inzicht verschaffen in de thermodynamische koppeling tussen levende organismen en hun omgeving.
Hoofdlijnen
- Wolven bleken meer coöperatief te zijn met hun eigen soort dan honden met die van hen
- Sterven mensen in politiehechtenis aan opgewonden delirium?
- Hoe de lengte van DNA-fragmenten te berekenen
- Ja,
- Bacteriën levenscyclus
- Wat is een fossiel?
- Virusstamping - een veelzijdige nieuwe methode voor genetische manipulatie van afzonderlijke cellen
- Oncogene: wat is het? & Hoe beïnvloedt het de celcyclus?
- mensen, in tegenstelling tot apen, verander de concurrentiesituatie in een coöperatieve
- Kunstmatige antimicrobiële peptiden kunnen helpen om resistente bacteriën te overwinnen
- Een nieuwe benadering om de katalysatoren voor de waterstofevolutiereactie te verbeteren

- Mangaan kan eindelijk het katalysatorprobleem van waterstofbrandstofcellen oplossen
- Onderzoekers onthullen de aard van het bodemwater en de faseovergang ervan
- Knipper en je zult amyloïden niet missen

 Astronomen detecteren grote hoeveelheden zuurstof in de atmosfeer van oude sterren
Astronomen detecteren grote hoeveelheden zuurstof in de atmosfeer van oude sterren Amerikaanse wetenschappers gered op Antarctica door ijsbreker in Argentinië
Amerikaanse wetenschappers gered op Antarctica door ijsbreker in Argentinië De gevolgen van het uitsterven van een organisme in een woestijn Ecosysteem voedselketen
De gevolgen van het uitsterven van een organisme in een woestijn Ecosysteem voedselketen Een zeer gevoelige nieuwe bloedtest kan zeldzame kankereiwitten detecteren
Een zeer gevoelige nieuwe bloedtest kan zeldzame kankereiwitten detecteren Vier redenen waarom het herstellen van de natuur de belangrijkste onderneming van onze tijd is
Vier redenen waarom het herstellen van de natuur de belangrijkste onderneming van onze tijd is Japan lanceert broodnodige voorraden naar ruimtestation
Japan lanceert broodnodige voorraden naar ruimtestation Update voor bestanden door Google ondersteunt USB-OTG
Update voor bestanden door Google ondersteunt USB-OTG Hoe wordt de evenwichtsconstante van een reactie bepaald?
Hoe wordt de evenwichtsconstante van een reactie bepaald?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


