Wetenschap
Knipper en je zult amyloïden niet missen
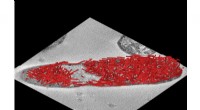
Amyloïden zijn zo klein dat ze niet kunnen worden gevisualiseerd met conventionele microscopische technieken. Een team van ingenieurs aan de Washington University in St. Louis heeft een nieuwe techniek ontwikkeld die gebruik maakt van tijdelijke fluorescentie, waardoor de amyloïden gaan flitsen, of 'knipper, ' en waardoor onderzoekers deze problematische eiwitten beter kunnen herkennen. Krediet:Washington University in St. Louis
Kleine eiwitstructuren, amyloïden genaamd, zijn de sleutel tot het begrijpen van bepaalde verwoestende ouderdomsziekten. Aggregaten, of kleverige samengeklonterde amyloïden, vormen plaques in de hersenen, en zijn de belangrijkste boosdoeners in de progressie van de ziekte van Alzheimer en Huntington.
Amyloïden zijn zo klein dat ze niet kunnen worden gevisualiseerd met conventionele microscopische technieken. Een team van ingenieurs aan de Washington University in St. Louis heeft een nieuwe techniek ontwikkeld die gebruik maakt van tijdelijke fluorescentie, waardoor de amyloïden gaan flitsen, of "knipper, " en waardoor onderzoekers deze problematische eiwitten beter kunnen herkennen.
"Het is best moeilijk geweest, een manier vinden om ze op een niet-invasieve manier in beeld te brengen - de manier waarop ze samenkomen niet veranderen - en ook een manier bedenken om ze op de lange termijn in beeld te brengen om te zien hoe ze klonteren en grotere structuren vormen, " zei Matthew Lew, assistent-professor in de Preston M. Green Department of Electrical &Systems Engineering aan de School of Engineering &Applied Science. "Dat was de focus van ons onderzoek."
Momenteel, wetenschappers die amyloïden willen visualiseren, gebruiken grote hoeveelheden fluorescerend materiaal om de eiwitten in een reageerbuis te coaten. Bij gebruik van een fluorescentiemicroscoop, de amyloïden gloeien. Echter, het is niet bekend hoe permanent gehechte kleurstoffen de basisstructuur en het gedrag van het amyloïde kunnen veranderen. Het is ook moeilijk om de nanoschaalstructuren te onderscheiden die in het spel zijn met deze grootschalige experimentele techniek.
Lew, wiens onderzoeksfocus superresolutiemicroscopie en beeldvorming met één molecuul omvat, werkte samen met zijn voormalige Washington University-collega Jan Bieschke, nu universitair hoofddocent hersenwetenschappen aan het University College in Londen, om de nieuwe techniek te ontwikkelen waardoor ze knipperen. Het wordt transient amyloid binding (TAB) beeldvorming genoemd.
TAB gebruikt een standaardkleurstof genaamd thioflavine T, maar in plaats van de amyloïden te coaten, het plakt er tijdelijk een voor een aan. Het effect is niet blijvend, en de amyloïden zenden licht uit totdat de kleurstof loslaat, waardoor een onderscheidend knippereffect ontstaat. Met behulp van een fluorescentiemicroscoop konden de onderzoekers de knipperingen observeren en vastleggen. Ze lokaliseerden vervolgens de positie van elke knipperende thioflavine en reconstrueerden een super-opgelost beeld van de exacte amyloïde structuur.
"De thioflavine T gedroeg zich als een groep vuurvliegjes, oplichten wanneer ze in contact komen met het amyloïde, ' zei Bieschke.
"Wat we zagen waren lichtflitsen in de loop van de tijd, " zei Lew. "Op onze computerschermen, je zou deze afzonderlijke vlekken achter elkaar zien knipperen. We waren toen in staat om al deze punten over elkaar heen te leggen, geeft ons een volledig beeld van de structuur. Als je ze niet uit elkaar hebt gehaald, je zou een waas zien."
Het team testte de TAB-techniek op een verscheidenheid aan amyloïde structuren en kon voor al deze structuren beelden reconstrueren. gedurende een langere periode en in verschillende stadia van aggregatie. Hun resultaten zijn onlangs gepubliceerd in het tijdschrift ChemBioChem .
"Er is een nauw verband tussen het zien van de structuur van de eiwitten en leren hoe deze eiwitten interageren met neuronen, " zei Lew. "Uiteindelijk, we hebben de beeldvorming nodig om alle verschillende vormen en structuren te begrijpen die deze eiwitten in de loop van de tijd opbouwen, en hoe dat zich verhoudt tot de dood van cellen later."
 Op polymeer gebaseerde optische vezel voor visualisatie van materiaalspanning
Op polymeer gebaseerde optische vezel voor visualisatie van materiaalspanning Sous-vide kookmethode maakt rundvleeseiwit beter verteerbaar
Sous-vide kookmethode maakt rundvleeseiwit beter verteerbaar Het werk aan een zeldzame molecule heeft tot doel de celtherapie te verbeteren en een functionele genezing voor HIV te leveren
Het werk aan een zeldzame molecule heeft tot doel de celtherapie te verbeteren en een functionele genezing voor HIV te leveren Team onthult eenvoudige methode om hoogwaardige lithium-seleniumbatterijen te produceren
Team onthult eenvoudige methode om hoogwaardige lithium-seleniumbatterijen te produceren Simulaties maken het mogelijk om stereochemie te kiezen voor je eigen avontuur
Simulaties maken het mogelijk om stereochemie te kiezen voor je eigen avontuur
 Eerste lockdown-effect op luchtvervuiling werd overschat, onze studie onthult
Eerste lockdown-effect op luchtvervuiling werd overschat, onze studie onthult Verbod op hoteltoiletartikelen is de nieuwste poging om plastic afval in te dammen
Verbod op hoteltoiletartikelen is de nieuwste poging om plastic afval in te dammen Storm brengt apocalyptische luchten naar Groot-Brittannië
Storm brengt apocalyptische luchten naar Groot-Brittannië Seismisch centrum:Caribische onderzeese vulkaan kan binnenkort uitbarsten
Seismisch centrum:Caribische onderzeese vulkaan kan binnenkort uitbarsten Twee enorme stormen in twee weken, maar zijn het volledig natuurrampen?
Twee enorme stormen in twee weken, maar zijn het volledig natuurrampen?
Hoofdlijnen
- Hoe doodt alcohol bacteriën?
- Wetenschappers vinden bloedmolecuul dat wolven aantrekt stoot mensen af
- Genetische studie onderzoekt manieren om de productiviteit en malsheid van vlees te verhogen
- Wat veroorzaakt de dubbele helix om te draaien in een DNA-afbeelding?
- Bepaling van allelfrequenties
- Wat zijn de voordelen van biodiversiteit?
- Door klimaat beïnvloede veranderingen in bloei, vruchtvorming heeft ook invloed op de vogelstand, activiteiten
- Lysosoom: definitie, structuur en functie
- Moet je intelligent zijn om slecht te zijn?
 Vroegtijdig waarschuwingssysteem voor aardbevingen betekent vals alarm, maar het is het nog steeds waard, onderzoekers zeggen:
Vroegtijdig waarschuwingssysteem voor aardbevingen betekent vals alarm, maar het is het nog steeds waard, onderzoekers zeggen: Hoe algen de kooldioxideconcentratie in de atmosfeer duurzaam kunnen verlagen
Hoe algen de kooldioxideconcentratie in de atmosfeer duurzaam kunnen verlagen Uitstoot koolstofarm maken is moeilijk, maar niet onmogelijk, zegt nieuwe recensie
Uitstoot koolstofarm maken is moeilijk, maar niet onmogelijk, zegt nieuwe recensie Europese servicemodulestructuur voor maanlanding arriveert in Bremen
Europese servicemodulestructuur voor maanlanding arriveert in Bremen Ontwikkeling van ultradun duurzaam membraan voor efficiënte scheiding van olie en water
Ontwikkeling van ultradun duurzaam membraan voor efficiënte scheiding van olie en water Orkaandelta teistert Caribische kust van Mexico
Orkaandelta teistert Caribische kust van Mexico Bio-geïnspireerd materiaal richt zich op uraniumvoorraden in oceanen voor duurzame kernenergie
Bio-geïnspireerd materiaal richt zich op uraniumvoorraden in oceanen voor duurzame kernenergie Science Project: het effect van massa op de afstand van een bal Travels
Science Project: het effect van massa op de afstand van een bal Travels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com