
Wetenschap
Katalysator voor de koolstofvrije productie van waterstofgas uit ammoniak
Krediet:Katsutoshi Nagaoka
(Phys.org) — Waterstof heeft het potentieel om een alternatief te bieden, schone energiebron, in het bijzonder zoals toegepast op brandstofceltechnologie. De huidige brandstofbronnen zijn koolstofhoudende fossiele brandstoffen of koolstofhoudende organische moleculen, die resulteren in de productie van overtollige CO 2 , een broeikasgas. Verschillende initiatieven, waaronder een nationaal initiatief in Japan, streven naar een koolstofarme gebruiksmaatschappij door gebruik te maken van alternatieve brandstofbronnen.
Het initiatief Energy Carriers in Japan is een nationaal project dat specifiek zoekt naar manieren om waterstof efficiënt op te slaan en te transporteren. Een manier om dit te doen is om ammoniak als waterstofbron te gebruiken. Echter, ontdekking van een efficiënt proces voor het afbreken van ammoniak is moeilijk gebleken, grotendeels omdat het katalytische proces om ammoniak af te breken de continue toevoeging van warmte vereist, die onbetaalbaar kan zijn.
Katsutoshi Nagaoka, Takaaki Eboshi, Yuma Takeishi, Ryo Tasaki, Kyoto Honda, Kazuya Imamura, en Katsutoshi Sato van de Oita University in Japan hebben een methode ontwikkeld die gebruik maakt van een nieuwe katalysator voor het produceren van waterstof uit ammoniak zonder toevoeging van externe warmte via de katalytische cyclus. Hun werk verschijnt in wetenschappelijke vooruitgang .
De ontleding van ammoniak in waterstof en stikstof is een endotherm proces, wat betekent dat het de toevoeging van energie vereist om producten te verkrijgen. Dit betekent dat traditionele katalytische ontledingsreacties de toevoeging van een grote hoeveelheid warmte vereisen om een bruikbare hoeveelheid waterstofgas te verkrijgen.
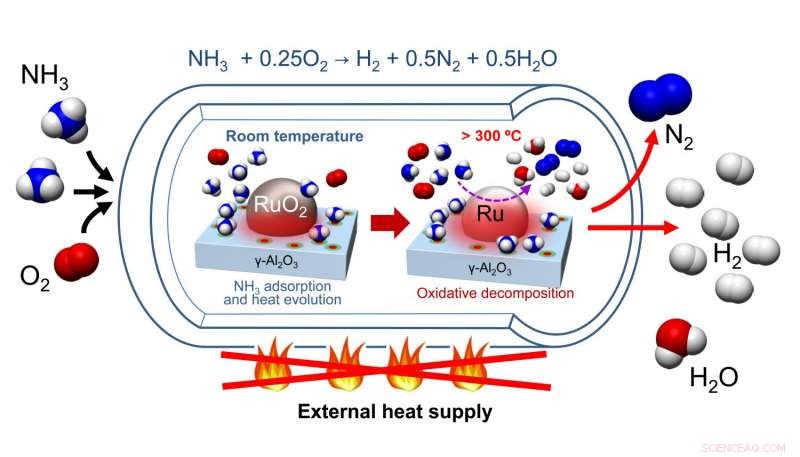
Nagaoka et al. ontwikkelde een katalysator die is gemaakt van een RuO 2 nanodeeltjes ondersteund op γ-Al 2 O 3 katalysator bed. Na het zuiveren van hun katalysator van H 2 O en CO 2 , ammoniak en zuurstof werden toegevoegd aan het reactievat waar ammoniak werd geadsorbeerd op het katalytische oppervlak, waardoor de temperatuur stijgt. Deze temperatuurstijging katalyseerde de oxidatieve ontleding van ammoniak, een exotherm proces. Dit verhitte de reactie, Die op zijn beurt, leverde de energie voor de endotherme ontleding van ammoniak in waterstof en stikstof.
De voorbehandeling van de katalysator vereiste verwarming om water en kooldioxide te verwijderen, maar het vereiste geen latere heropwarming. Testen op katalysatorcycli toonden aan dat na de eerste voorbehandeling van de RuO 2 /γ-Al 2 O 3 katalysator met helium bij 300 O C, de katalysator was in staat drie keer te circuleren en toch waterstof te produceren in maximale opbrengsten. Verder, deze studies omvatten oxidatieve passivering om ervoor te zorgen dat er geen warmte werd geproduceerd door oxidatie van Ru tot RuO 2 . In praktijk, oxidatieve passivering is niet nodig. Dus, hoewel verwarming nodig is om de katalysator voor te behandelen, verwarming is niet vereist voor extra cycli van de katalysator.
In een poging om te begrijpen hoe de RuO 2 /γ-Al 2 O 3 katalysator werkt, Nagaoka et al. vergeleek de maximale katalytische bedtemperatuur die het gevolg is van zelfverhitting van RuO 2 / -Al 2 O 3 naar RuO 2 /La 2 O 3 , een bekende ammoniakontledingskatalysator. Ze ontdekten dat de op aluminium gebaseerde katalysator werd verwarmd tot een maximale temperatuur van 97 O C, terwijl de op lanthaan gebaseerde katalysator werd verwarmd tot een maximale temperatuur van 53 O C. Dit is belangrijk omdat de zelfontbrandingstemperatuur voor de oxidatieve verbranding van ammoniak 90 . is O C, en het verklaart waarom er betere reactieopbrengsten werden gezien met RuO 2 / -Al 2 O 3 .
De auteurs wijzen erop dat dit verschil in adsorptietemperatuur waarschijnlijk te wijten is aan de gunstige interactie tussen ammoniak, een basismolecuul, en Ali 2 O 3 , wat een Lewis-zuur is. La 2 O 3 , anderzijds, is een Lewis-base.
Aanvullend, de auteurs keken naar het verschil tussen het gebruik van kale γ-Al 2 O 3 als katalysator en RuO 2 / -Al 2 O 3 . Ze ontdekten dat 90% van de ammoniak adsorbeert op kale γ-Al2O3 in vergelijking met het katalysatorbed en de RuO 2 nanodeeltje. Dit houdt in dat ammoniak chemisch wordt geabsorbeerd op het nanodeeltje en γ-Al 2 O 3 , die vervolgens meerlaagse fysisorptie bevordert.
Algemeen, dit type katalysator is nuttig bij het leveren van voldoende warmte om de benodigde warmtevereisten voor de endotherme ontleding van ammoniak in waterstof en stikstofgas te overwinnen. Deze studie toont aan dat zelfverhittingskatalyse een haalbare optie is om oplossingen te zoeken voor de praktische problemen bij het gebruik van ammoniak als brandstof voor waterstof.
© 2017 Fys.org
 Besprenkeld met kracht:hoe onzuiverheden een thermo-elektrisch materiaal versterken op atomair niveau
Besprenkeld met kracht:hoe onzuiverheden een thermo-elektrisch materiaal versterken op atomair niveau Hoe Atomen in Gram te converteren
Hoe Atomen in Gram te converteren  Mistharp vergroot opvangcapaciteit voor schoon water
Mistharp vergroot opvangcapaciteit voor schoon water Hoe te verwijderen totaal opgeloste stoffen uit Drinkwater
Hoe te verwijderen totaal opgeloste stoffen uit Drinkwater Mixed and matched:Integratie van metaal-organische raamwerken in polymeren voor kooldioxideafscheiding
Mixed and matched:Integratie van metaal-organische raamwerken in polymeren voor kooldioxideafscheiding
 Hoe NASA de wereld helpt gemakkelijker te ademen
Hoe NASA de wereld helpt gemakkelijker te ademen Eerste poging in zijn soort om de impact van plankton op de koolstofcyclus van de aarde te onderzoeken
Eerste poging in zijn soort om de impact van plankton op de koolstofcyclus van de aarde te onderzoeken Het effect van watervervuiling op het land
Het effect van watervervuiling op het land  Amerikaanse functionaris steunt samenwerking op het gebied van schone energie met China
Amerikaanse functionaris steunt samenwerking op het gebied van schone energie met China Droge bliksem heeft Tasmanië in vuur en vlam gezet, en klimaatverandering maakt het waarschijnlijker dat het opnieuw gebeurt
Droge bliksem heeft Tasmanië in vuur en vlam gezet, en klimaatverandering maakt het waarschijnlijker dat het opnieuw gebeurt
Hoofdlijnen
- Hoe Cytoplasma voor een celproject te maken
- Golgi-apparaat: functie, structuur (met analogie en diagram)
- Verschil tussen bacterie- en plantencel Wall
- Wat is het belang van nucleïnezuren?
- Soorten berekenen Evenness
- Stijgende CO2 zorgt ook voor overlast in zoetwater, studie suggereert:
- Wat gebeurt er als je een lijk ontdooit?
- Nieuwe studie biedt inzicht in een hondenleven in gezinnen met kinderen
- Geautomatiseerde biologie, of hoe je een populatie cellen kunt besturen met een computer
 Risico dat boomsoorten verdwijnen in Centraal-Afrika een grote zorg, zeggen onderzoekers
Risico dat boomsoorten verdwijnen in Centraal-Afrika een grote zorg, zeggen onderzoekers Rassendiscriminatie kan de cognitie bij Afro-Amerikanen negatief beïnvloeden
Rassendiscriminatie kan de cognitie bij Afro-Amerikanen negatief beïnvloeden Hoe maak je een model van het pompende menselijke hart
Hoe maak je een model van het pompende menselijke hart  Hoe machine learning taal- en handelsbarrières kan doorbreken
Hoe machine learning taal- en handelsbarrières kan doorbreken Berekeningen bevestigen dat oppervlaktefouten de oorzaak zijn van de intermitterende fluorescentie in silicium nanokristallen
Berekeningen bevestigen dat oppervlaktefouten de oorzaak zijn van de intermitterende fluorescentie in silicium nanokristallen Herontdekt Andy Warhol-interview verkent pop-art en queerness
Herontdekt Andy Warhol-interview verkent pop-art en queerness De Amerikaanse regering zou opnieuw satellietgegevens in rekening kunnen brengen - hier is waarom dat een grote fout zou zijn
De Amerikaanse regering zou opnieuw satellietgegevens in rekening kunnen brengen - hier is waarom dat een grote fout zou zijn Steden afbreken als hoogbouw hun uiterste gebruiksdatum bereikt
Steden afbreken als hoogbouw hun uiterste gebruiksdatum bereikt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | French | Swedish |

-
Wetenschap © https://nl.scienceaq.com






