
Wetenschap
Wetenschappers bepalen de snelheid van het breken en fixeren van diwaterstofmoleculen
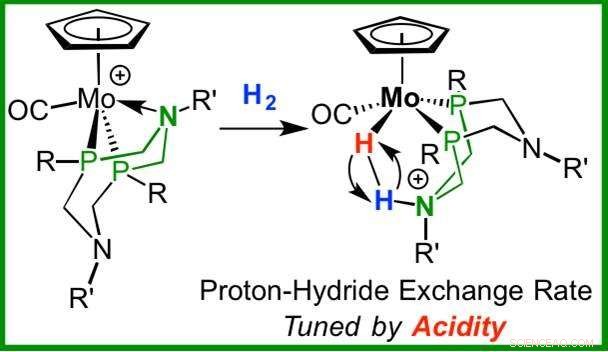
Dit molecuul werd in situ gegenereerd door hydride-abstractie uit n-fluorbenzeen. Krediet:Pacific Northwest National Laboratory
Waterstof is het meest voorkomende element in het heelal. Het diwaterstofmolecuul, met een H-H binding, is een van de eenvoudigste en meest flexibele in de chemie. Om een diwaterstofbinding te splitsen om energie te produceren of op te slaan, moet de katalysator worden ontworpen met de perfecte balans van eigenschappen om de gewenste reactiviteit te bereiken. In aanvulling, het vermogen om dat molecuul zichzelf weer in elkaar te laten zetten en om de snelheid van montage en demontage te regelen, is belangrijk bij de productie van schone brandstoffen. Morris Bullock en zijn collega's van het Pacific Northwest National Laboratory kregen controle over de snelheid van splitsing en hermontage van een diwaterstofmolecuul.
In de voortdurende zoektocht naar schone brandstofproductie, wetenschappers hebben eenvoudige manieren onderzocht om het waterstofmolecuul heterolytisch in twee ongelijke producten te splitsen. Het begrijpen van de eigenschappen van splitsing van heterolytische diwaterstofbindingen en het beheersen van de locatie en energie van het resulterende proton en negatief geladen hydride is belangrijk voor het ontwerp van nieuwe katalysatoren voor brandstofcellen en andere schone energiebronnen.
De diwaterstofbinding is de eenvoudigste in de chemie, maar biedt een flexibiliteit in de manier waarop de binding wordt verbroken. Het kan op twee verschillende manieren worden gebroken, homolytisch of heterolytisch, in twee identieke fragmenten of twee verschillende geladen fragmenten, een proton en hydride. Heterolytische splitsing is het breken van het bindende elektronenpaar in twee ongelijke producten. Dit is een gangbaar proces bij het gebruik van waterstof in brandstofcellen en bij in de natuur voorkomende biologische processen waarbij enzymen waterstof oxideren. Omgekeerde heterolytische splitsing is het proces van het nemen van deze ongelijke fragmenten en het reconstrueren ervan naar hun oorspronkelijke structuur; dat is, het combineren van het proton en hydride en het creëren van diwaterstof.
Voorafgaand aan deze studie, Bullock en zijn collega's onderzochten hoe diwaterstofbindingen worden verbroken en worden hervormd tot een diwaterstofmolecuul. "Wat we proberen te doen, is de juiste elektronische kenmerken vinden, zodat de energie die nodig is voor splitsing laag is, " zegt Bullock, een katalyse wetenschapper.
Het ontwerpen van dit molecuul is een evenwichtsoefening. Eerdere iteraties van deze moleculen waren ofwel te sterk aan de katalysator gebonden na splitsing of waren te zwak om aan de katalysator te binden. In antwoord, PNNL-wetenschappers creëerden een reeks op molybdeen gebaseerde katalysatoren, waarvoor de snelheid van H-H-splitsing en hermontage systematisch kon worden gevarieerd.
In aanvulling, Bullock en zijn collega's bewezen dat er een mechanisme bestaat om de snelheid van omkeerbare heterolytische splitsing te regelen. Met behulp van nucleaire magnetische resonantie spectroscopie bij PNNL, ze observeerden de reactie zoals deze plaatsvond. Verder, ze controleerden de splitsingssnelheid door de elektronische kenmerken van de metaalcomplexen systematisch te veranderen. Sommige van deze bindingen splitsen en herassembleren bijna 10 miljoen keer per seconde bij kamertemperatuur. Door de zuurgraad van deze complexen te veranderen, de omkeerbare heterolytische splitsingssnelheid kan met een factor 10 worden gewijzigd, 000.
Het begrijpen van de thermodynamische en kinetische eigenschappen van splitsing van heterolytische diwaterstofbindingen en het beheersen van de overdracht van het proton en hydride zijn van cruciaal belang voor het ontwerp van nieuwe katalysatoren. De volgende stap is bepalen hoe de H-H-bindingen kunnen worden gesplitst en hoe de levering van protonen en hydriden kan worden gecontroleerd nadat de H-H-binding is verbroken.
 Materiaal gevormd uit krabschalen en bomen zou flexibele plastic verpakkingen kunnen vervangen
Materiaal gevormd uit krabschalen en bomen zou flexibele plastic verpakkingen kunnen vervangen Biosensortechnologieën om effectievere benaderingen van ziektebehandeling te bieden
Biosensortechnologieën om effectievere benaderingen van ziektebehandeling te bieden Eiwitveranderingen gaan vooraf aan foto-isomerisatie van retinale chromofoor
Eiwitveranderingen gaan vooraf aan foto-isomerisatie van retinale chromofoor Verankerd door een dichte buurt:wat voorkomt dat cellen afdwalen?
Verankerd door een dichte buurt:wat voorkomt dat cellen afdwalen? Spinzijde:een kneedbaar eiwit zorgt voor versterking
Spinzijde:een kneedbaar eiwit zorgt voor versterking
Hoofdlijnen
- Ideeën voor Cookie Science Fair Projects
- Tasmaanse tijger gedoemd lang voordat er mensen kwamen
- Wat zijn drie primaire doelen van mitose?
- Wat gebruiken chloroplasten om glucose te maken?
- Retrovirus versus DNA-virus
- Wat is het belang van virtual reality voor artsen en chirurgen?
- Doel van een Cell
- Onderzoekers kijken naar de fruitvlieg om het menselijk brein te begrijpen
- Belang van aërobe celbeademing
- Archaea-enzym dat membraanlipiden produceert, is spectaculair promiscue
- Afbreekbare elektronische componenten gemaakt van maïszetmeel
- Onderzoekers ontwerpen een verbeterde route naar koolstofneutrale kunststoffen

- Hoe te identificeren of een oplossing neutraal, base of zuur is

- Onderzoekers stellen een nieuwe benadering voor om heterogene fotosynthese van azoverbindingen te verbeteren
 Het voorstellen van een succesvolle toekomst kan leerlingen helpen om alledaagse moeilijkheden te overwinnen
Het voorstellen van een succesvolle toekomst kan leerlingen helpen om alledaagse moeilijkheden te overwinnen Het sociale leven van vissen kan de sleutel zijn tot het redden van koraalriffen
Het sociale leven van vissen kan de sleutel zijn tot het redden van koraalriffen Straintronic spin-neuron kan neurale computing aanzienlijk verbeteren
Straintronic spin-neuron kan neurale computing aanzienlijk verbeteren Wijzigingen in het watersysteem volgen door te luisteren naar communicatie van microalgen
Wijzigingen in het watersysteem volgen door te luisteren naar communicatie van microalgen Magnetische texturen manipuleren
Magnetische texturen manipuleren Hoe een Variac te gebruiken
Hoe een Variac te gebruiken  Giftige smog bedekt de ochtend van New Delhi na Diwali-festiviteiten
Giftige smog bedekt de ochtend van New Delhi na Diwali-festiviteiten Openingsargumenten in AT&T-antitrustproces uitgesteld
Openingsargumenten in AT&T-antitrustproces uitgesteld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

