
Wetenschap
Mechanisme voor hMTH1s brede substraatspecificiteit onthuld
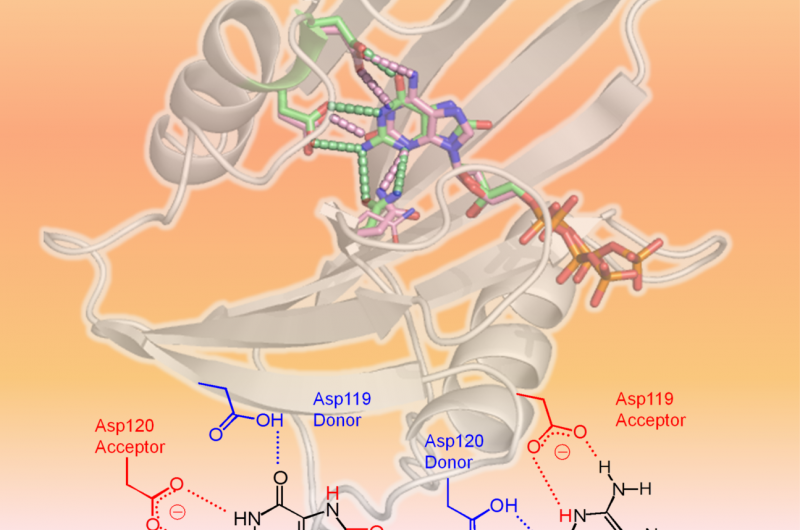
hMTH1 herkent twee geoxideerde dNTP's zoals weergegeven in de 3D-structuur (bovenste gedeelte van afbeelding:hMTH1, lintje; beschadigde dNTP's, stokjes). De bepalende factor in de brede substraatspecificiteit zijn verschillende protoneringstoestanden tussen Asp-119 en Asp-120 (onderste gedeelte van de figuur). Krediet:professor Yuriko Yamagata
Humaan MutT homoloog 1 (hMTH1) eiwit fungeert als het primaire enzym voor het afbreken (hydrolyseren) van beschadigde (geoxideerde) deoxynucleosidetrifosfaten (dNTP's) de substraten van DNA-synthese. Onlangs, hMTH1 heeft de aandacht getrokken als een populair doelwit voor nieuwe antikankertherapieën omdat het niet essentieel is voor normale cellen, maar kankercellen hebben het nodig om te voorkomen dat geoxideerde nucleotiden in het DNA worden opgenomen, wat zou resulteren in de dood van kankercellen. Nutsvoorzieningen, hMTH1-remmers zijn ontwikkeld als kandidaat-geneesmiddelen tegen kanker. Hoewel sommige rapporten pleiten tegen het nut van hMTH1-remming, zeer krachtige en selectieve remmers van hMTH1, die de introductie van geoxideerde nucleotiden in het DNA van kankercellen mogelijk zou maken, worden verwacht voor toekomstige kankerbehandelingen.
Enzymen zijn meestal erg kieskeurig over het materiaal dat ze katalyseren (substraat). Sommige, echter, kan meer dan één substraat katalyseren, en van hMTH1 is bekend dat het verschillende geoxideerde dNTP's hydrolyseert. De redenen achter de brede substraatspecificiteit waren nog niet onderzocht toen onderzoekers uit Japan het probleem begonnen te overwegen.
Wetenschappers van de Kumamoto University, de nationale instituten voor kwantum- en radiologische wetenschap en technologie, en Kyushu University hebben structurele en kinetische analyses uitgevoerd op hMTH1 om de mechanismen te bepalen achter het vermogen om verschillende geoxideerde mutagene dNTP's te hydrolyseren, zoals 8-oxo-dGTP en 2-oxo-dATP, met vergelijkbare efficiëntie. Hun experimenten vonden bewijs dat de protoneringstoestand tussen de aspartaatresiduen Asp-119 en Asp-120 de bepalende factor was in de brede substraatspecificiteit van hMTH1. Met andere woorden, de toevoeging of verwijdering van een of meer protonen op Asp-119 of Asp-120 zorgt ervoor dat hMTH1 8-oxo-dGTP of 2-oxo-dATP herkent. Hierdoor kan hMTH1 de geoxideerde mutagene dNTP's hydrolyseren voordat ze worden gebruikt voor DNA-synthese; DNA dat geoxideerde nucleotiden bevat, zou de dood van kankercellen veroorzaken.
"We ontdekten dat verschillende protoneringstoestanden tussen Asp-119 en Asp-120 het signaal zijn voor hMTH1 om de beschadigde nucleotiden te hydrolyseren. Als deze actie door hMTH1 kan worden onderdrukt, kankercellen zouden beschadigde nucleotiden ophopen en uiteindelijk apoptose ondergaan, " zei professor Yuriko Yamagata van de Kumamoto University, leider van de onderzoeksgroep. "De verduidelijking van dit mechanisme zou moeten helpen bij de ontwikkeling van hMTH1 die zich richt op geneesmiddelen tegen kanker."
 Chemiluminescentiesondes voor de snelle en gevoelige detectie van salmonella en listeria
Chemiluminescentiesondes voor de snelle en gevoelige detectie van salmonella en listeria Hoe de optimale temperatuur voor een enzym te meten
Hoe de optimale temperatuur voor een enzym te meten  Apparaat kan ziekte horen door structuren waarin cellen zijn ondergebracht
Apparaat kan ziekte horen door structuren waarin cellen zijn ondergebracht Een veranderende platina-elektrode observeren
Een veranderende platina-elektrode observeren Metalen organische kaders metalen meesterschap
Metalen organische kaders metalen meesterschap
Hoofdlijnen
- Vogels leren van elkaars walging, waardoor insecten felle kleuren kunnen ontwikkelen
- Vergelijking van de hoeveelheid energie die twee soorten Galapagos-schildpadden nodig hebben om om te keren als ze eenmaal zijn omgedraaid
- High School Biology Experiment Ideas
- Waar ligt de grens tussen fandom en obsessie?
- U kunt gecodeerde woorden lezen - onder bepaalde omstandigheden
- 10 dingen die linkshandigen beter doen
- Het geheim van de winterslaap van schildpadden is de billenademhaling
- Deze 8 foto's van puppy's kunnen je helpen focussen,
- Onderzoekers ontsluiten mogelijk pad om vleesetende bacteriën te behandelen
- Gecombineerde databenadering kan de ontwikkeling van nieuwe materialen versnellen
- Atomen plaatsen voor optimale katalysatoren
- Video:Wat is er precies gebeurd in Tsjernobyl?

- Chemische eigenschappen van benzoëzuur
- Wetenschappers decoderen de dynamiek van de grootste eiwitafbrekende machine in atomaire details

 Reparaties met lichtsignalen
Reparaties met lichtsignalen Wat is de zeldzaamste metaal?
Wat is de zeldzaamste metaal?  Topologische isolatoren hebben verliesvrije geleiding aan de randen
Topologische isolatoren hebben verliesvrije geleiding aan de randen Onderzoek creëert waterstofproducerende levende druppeltjes, weg vrijmaken voor alternatieve toekomstige energiebron
Onderzoek creëert waterstofproducerende levende druppeltjes, weg vrijmaken voor alternatieve toekomstige energiebron Satellieten volgen de voedselvoorziening van de naties
Satellieten volgen de voedselvoorziening van de naties Politieke polarisatie gedestilleerd met behulp van datawetenschap
Politieke polarisatie gedestilleerd met behulp van datawetenschap Duitsland zou over 10 jaar de laatste gletsjers kunnen verliezen
Duitsland zou over 10 jaar de laatste gletsjers kunnen verliezen Hoe u uw kandidaat-nummer kunt vinden
Hoe u uw kandidaat-nummer kunt vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

