
Wetenschap
Sleuteleiwit reguleert de immuunrespons op virussen in zoogdiercellen
Hoewel algemeen wordt aangenomen dat RNA-uitschakeling een mechanisme is dat onder normale omstandigheden werkt om de genexpressie te controleren (als het gen wordt 'aangezet' om de cel instructies te geven om het specifieke eiwit waarvoor het codeert samen te stellen), is het nog steeds onduidelijk hoe dit proces kan verlopen. treedt op onder de stress van een virale infectie.
Daarom keken de onderzoekers naar TRBP (een afkorting voor TAR RNA-bindend eiwit), dat een belangrijke rol heeft aangetoond bij het uitschakelen van RNA tijdens een virale infectie.
Dit eiwit interageert al vroeg in de fasen van infectie in menselijke cellen met een virussensoreiwit. In de latere stadia van een virale infectie worden eiwitten genaamd caspasen geactiveerd, en dit type eiwit is voornamelijk verantwoordelijk voor het veroorzaken van celdood.
“RNA-uitschakeling en interferonsignalering werden voorheen als onafhankelijke routes beschouwd, maar meerdere rapporten, waaronder de onze, hebben overspraak tussen beide aangetoond”, zegt Kumiko Ui-Tei, een andere co-auteur en universitair hoofddocent aan de Universiteit van Tokio (ten tijde van het onderzoek). het onderzoek).
Deze functionele omzetting van TRBP veroorzaakt door virale infectie is de basis van het reguleren van de interferonrespons en apoptose, waarbij TRBP de geprogrammeerde celdood van geïnfecteerde cellen onomkeerbaar verhoogt, terwijl de interferonsignalering wordt verminderd. TRBP werkt op de cel door celdood te induceren, waardoor de virale replicatie volledig wordt gestopt, in tegenstelling tot de interferonresponsroute, die de virale replicatie alleen onderdrukt in plaats van de geïnfecteerde cellen te elimineren.
"Het uiteindelijke doel is het begrijpen van het moleculaire mechanisme dat ten grondslag ligt aan het antivirale afweersysteem, georkestreerd door de wisselwerking tussen interne en externe RNA-routes in menselijke cellen", aldus Takahashi.
Door een beter inzicht te krijgen in de manier waarop de verdediging tegen virussen op moleculair niveau werkt, willen de onderzoekers de ontwikkeling van nucleïnezuurmedicijnen stimuleren. Deze geneesmiddelen maken gebruik van targeting- en inhibitiebenaderingen die vergelijkbaar zijn met de antivirale respons van RNA-uitschakeling, en ze beloven steeds nuttiger te worden bij de behandeling van een breder scala aan patiënten die lijden aan virale infecties, genetische mutaties en genetische defecten.
Deze studie werd uitgevoerd in samenwerking met Saitama University, Chiba University, Kyoto University en Maebashi Institute of Technology in Japan.
Meer informatie: Caspase-gemedieerde verwerking van TRBP reguleert apoptose tijdens virale infectie, Nucleïnezurenonderzoek (2024). DOI:10.1093/nar/gkae246
Journaalinformatie: Nucleïnezurenonderzoek
Aangeboden door Universiteit van Tokio 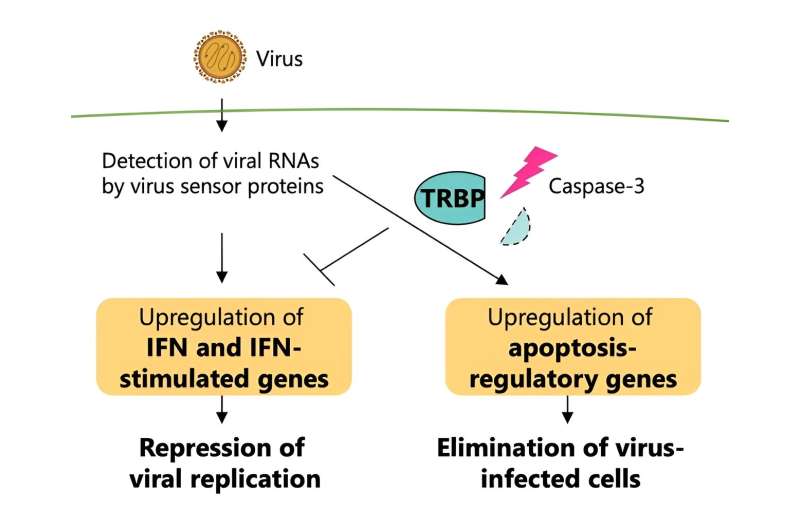
Hoofdlijnen
- De nanoscopische structuur die onze genen opsluit
- Onderzoekers vinden lage genetische diversiteit bij gedomesticeerde fretten
- Hoe een onbekende bacterie te identificeren in de microbiologie
- Waarom likken en kauwen katten kattenkruid? Onderzoekers vinden een antwoord
- Een klimaatschurk? De impact van vlees op de planeet meten en beheren
- Welke effecten kunnen glycolyse remmen?
- Hoe jaloezie werkt
- Wat is het eindproduct van fotosynthese?
- De structuur en functie van spiercellen
- Keizerspinguïns kunnen record snel inkorten door te snacken

- Studie vindt potentiële celreceptoren om antibioticaresistentie te verminderen
- Moderne mensen genereren meer hersenneuronen dan Neanderthalers

- De wetenschap achter waarom sommige mensen van dieren houden en anderen niets kan schelen

- Een biobank van omkeerbare mutante embryonale stamcellen
 Hoe een Meade Telescope
Hoe een Meade Telescope Natuurkundigen bewijzen dat het onmogelijk is om een object af te koelen tot het absolute nulpunt
Natuurkundigen bewijzen dat het onmogelijk is om een object af te koelen tot het absolute nulpunt Hoe een Samick-serienummer te lezen
Hoe een Samick-serienummer te lezen  Hoe een gebied naar vierkante voet te converteren
Hoe een gebied naar vierkante voet te converteren  Uitbarstingen van zwarte gaten kunnen mini-Neptunes veranderen in rotsachtige werelden
Uitbarstingen van zwarte gaten kunnen mini-Neptunes veranderen in rotsachtige werelden Een lage temperatuur nanodeeltjesinkt
Een lage temperatuur nanodeeltjesinkt Hoe de ijstijden de evolutie van de vreemde en stugge inheemse planten in Nieuw-Zeeland hebben gestimuleerd
Hoe de ijstijden de evolutie van de vreemde en stugge inheemse planten in Nieuw-Zeeland hebben gestimuleerd Blootgesteld:het pad van ransomware-betalingen
Blootgesteld:het pad van ransomware-betalingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


