
Wetenschap
Onderzoek toont aan dat planten het gebruik van corrigerende Tipp-Ex-eiwitten beperken
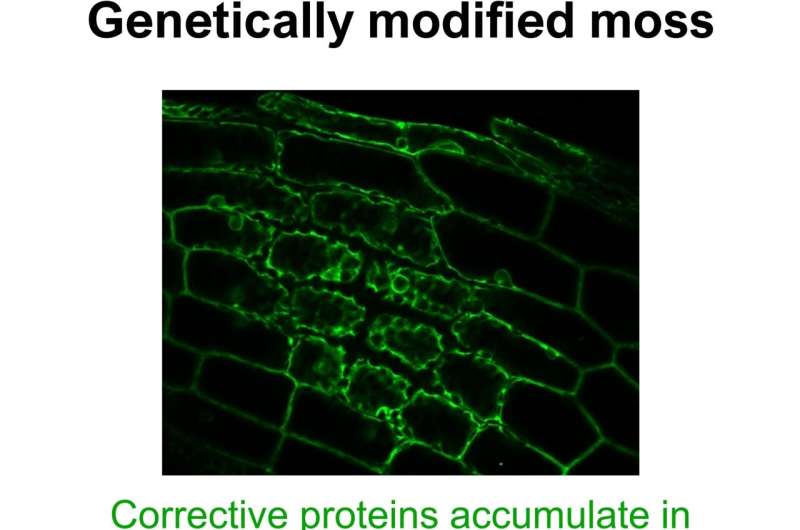
Planten beschikken over speciale corrigerende moleculen die retrospectieve wijzigingen kunnen aanbrengen in kopieën van genen. Het lijkt er echter op dat deze "Tipp-Ex-eiwitten" geen toestemming hebben om in alle delen van de cel te werken, maar alleen worden gebruikt in chloroplasten en mitochondriën.
Een onderzoek van de Universiteit van Bonn heeft nu uitgelegd waarom dit het geval is. Het suggereert dat het correctiemechanisme anders kopieën zou wijzigen waar niets mis mee is, met fatale gevolgen voor de cel. De bevindingen zijn gepubliceerd in The Plant Journal .
Plantencellen bezitten een hele reeks gespecialiseerde structuren die bekend staan als organellen, waarvan twee bijzonder belangrijke de chloroplasten en mitochondriën zijn. De eerstgenoemden gebruiken lichtenergie om koolstofdioxide en water om te zetten in zuurstof en suiker, terwijl de laatstgenoemden min of meer hetzelfde in omgekeerde volgorde doen:ze ‘verbranden’ suiker en andere verbindingen om de energie op te wekken die nodig is voor tal van cellulaire processen.
De twee organellen zijn uniek omdat ze hun eigen genen hebben. Dit genetische materiaal werkt als sets van assemblage-instructies voor sleutelmoleculen die de organellen nodig hebben voor hun werk. Als een bladgroenkorrel bijvoorbeeld een bepaald eiwit moet maken, bestelt hij eerst een kopie van de betreffende montagehandleiding, waarmee hij vervolgens het eiwit kan maken.
Genen uit bladgroenkorrels en mitochondriën zijn vaak defect
"De genen in chloroplasten en mitochondriën bevatten echter vaak defecten", legt Elena Lesch uit, een promovendus aan het Instituut voor Cellulaire en Moleculaire Botanie van de Universiteit van Bonn. "De kopieën moeten dus gecorrigeerd worden, anders zullen de op basis van hun instructies samengestelde eiwitten niet werken."
Hiervoor gebruiken planten een soort Tipp-Ex:speciale moleculen die behoren tot de groep van pentatricopeptide repeat (PPR) eiwitten.
Planten beschikken over minstens een dozijn en in sommige gevallen zelfs enkele duizenden van deze speciale PPR-eiwitten, die elk zeer specifieke defecten corrigeren. Het is alsof elk woord in een krant zijn eigen subredacteur heeft. De PPR-eiwitten worden echter niet gemaakt in de organellen waarin ze worden gebruikt, maar buiten de organellen, in het cytosol.
Het cytosol zit ook boordevol genkopieën, hoewel deze afkomstig zijn uit de celkern, waar de meeste van de vele duizenden genen van de plant zijn opgeslagen. Daarentegen bevatten mitochondriën en chloroplasten elk slechts enkele tientallen genen. De "Tipp-Ex-eiwitten" zouden theoretisch ook de kopieën in het cytosol kunnen corrigeren. "Maar dat doen ze niet", zegt Lesch. "Ze doen alleen hun werk in de organellen, en we wilden weten waarom."
Het transportmechanisme in de organellen onderbrengen
Eén reden zou kunnen zijn dat de ‘moleculaire sub-editors’ simpelweg te snel van het cytosol naar de organellen worden verplaatst. Om deze mogelijkheid te onderzoeken, pasten de onderzoekers een soort moleculaire schakelaar toe op PPR-genen in een deel van het mos Physcomitrium. Hierdoor konden ze de cellen vrijwel met één druk op de knop zeer grote hoeveelheden PPR-eiwitten laten produceren.
"We konden aantonen dat dit het transportmechanisme ondermijnt", onthult Lesch's collega Mirjam Thielen, die veel van de experimenten uitvoerde. "Het veroorzaakte een opeenhoping van PPR-eiwitten in het cytosol."
Toen ze eenmaal in het cytosol waren aangekomen, begonnen ze kopieën van de kern te modificeren. "We analyseerden de veranderingen die ze aanbrachten en zagen dat de eiwitten een groot aantal sets montage-instructies hadden aangepast die feitelijk correct zouden zijn geweest", zegt Lesch.
"Dit soort onjuiste interventies zijn uiteraard contraproductief, omdat ze de eiwitfuncties in gevaar kunnen brengen." Maar waarom zou dit überhaupt moeten gebeuren? Naast het detecteren van defecten binden de PPR-eiwitten zich ook aan zogenaamde off-target-sequenties, gebieden die op een defecte sequentie lijken, maar in werkelijkheid prima in orde zijn.
"Met kopieën van tienduizenden genen die strijden om ruimte in het cytosol, zou het risico groot zijn dat deze afwijkende sequenties onjuist worden gecorrigeerd", merkt Lesch op.
Productie van 'Tipp-Ex'-moleculen onderworpen aan strikte regelgeving
Om dit te voorkomen maken planten doorgaans slechts relatief kleine hoeveelheden PPR-eiwitten aan, die vervolgens rechtstreeks naar de organellen worden getransporteerd voordat de moleculaire "Tipp-Ex" in het cytosol schade kan aanrichten. Omdat het aantal genen – en dus hoeveel kopieën ervan er zijn – in de chloroplasten en mitochondriën beheersbaar is, komen dergelijke miscorrecties daar meestal niet voor.
De studie levert nieuwe inzichten op over hoe deze corrigerende eiwitten hun doelwitten identificeren. In de toekomst kan het daarom mogelijk zijn om de bevindingen te gebruiken om zeer gerichte wijzigingen aan te brengen in specifieke kopieën van genen in de mitochondriën en chloroplasten, en om het effect van dergelijke wijzigingen te onderzoeken.
Gezien de belangrijke rol die deze organellen spelen in het energiemetabolisme van planten, opent dit ook ruimte voor enkele interessante praktische toepassingen.