
Wetenschap
De evolutie van slijm:hoe zijn we aan al dit slijm gekomen?

Petar Pajic, UB-promovendus in de biologische wetenschappen, bereidt een speekselmonster voor scheiding en analyse. In de nieuwe studie gebruikte het team een gelelektroforesetechniek om mucinen van andere eiwitten in het speeksel van verschillende zoogdieren te scheiden. Credit:Douglas Levere / Universiteit in Buffalo
Van de slijmlaag tot het speeksel in onze mond, veel glibberige lichaamsvloeistoffen bevatten slijm. Dus hoe is dit wonder van de biologie geëvolueerd?
Bij zoogdieren is het antwoord vaak, en vaak op een verrassende manier, volgens een nieuwe studie over eiwitten die mucinen worden genoemd. Deze moleculen hebben verschillende functies, maar als familie staan ze bekend als componenten van slijm, waar ze bijdragen aan de kleverige consistentie van de stof.
Door een vergelijking van mucine-genen bij 49 zoogdiersoorten, identificeerden wetenschappers 15 gevallen waarin nieuwe mucines lijken te zijn geëvolueerd door een additief proces dat een niet-mucine-eiwit in een mucine transformeerde.
De wetenschappers stellen voor dat elk van deze "mucinisatie" -gebeurtenissen begon met een eiwit dat geen mucine was. Op een gegeven moment heeft de evolutie een nieuwe sectie op deze niet-mucinebasis geplakt:een die bestaat uit een korte keten van bouwstenen, aminozuren genaamd, die zijn versierd met suikermoleculen. Na verloop van tijd werd deze nieuwe regio gedupliceerd, met meerdere kopieën toegevoegd om het eiwit nog verder te verlengen, waardoor het een mucine werd.
De verdubbelde regio's, "herhalingen" genoemd, zijn de sleutel tot de functie van mucine, zeggen de onderzoekers van de Universiteit van Buffalo, Omer Gokcumen en Stefan Ruhl, de senior auteurs van de studie, en Petar Pajic, de eerste auteur.
De suikers die deze secties bedekken, steken naar buiten uit als de borstelharen van een flessenborstel, en ze verlenen mucinen de slijmerige eigenschap die essentieel is voor veel belangrijke taken die deze eiwitten uitvoeren.
Het onderzoek wordt op 26 augustus gepubliceerd in Science Advances.
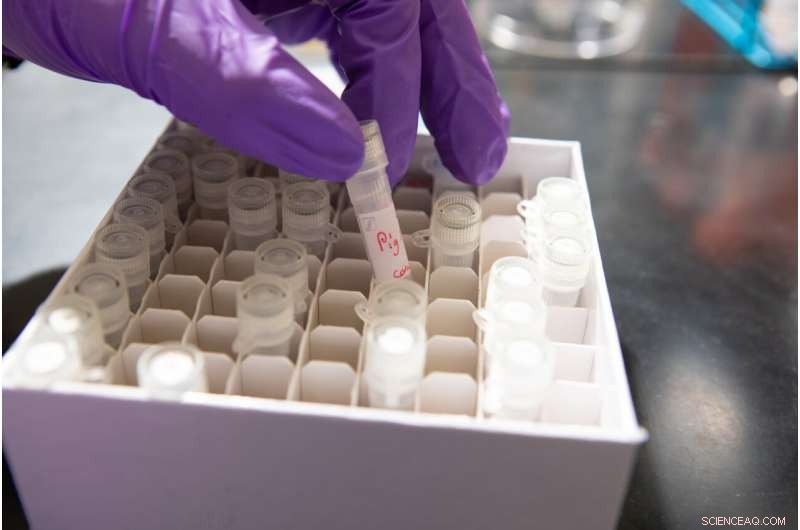
Flesjes speeksel verzameld van verschillende zoogdieren, waaronder een varken. Credit:Douglas Levere / Universiteit in Buffalo
"Ik denk niet dat het eerder bekend was dat de eiwitfunctie op deze manier kan evolueren, van een eiwit dat herhaalde sequenties krijgt. Een eiwit dat geen mucine is, wordt een mucine door alleen maar herhalingen te krijgen. Dit is een belangrijke manier waarop evolutie slijm maakt Het is een evolutionaire truc en we documenteren dit steeds weer opnieuw", zegt Gokcumen, Ph.D., universitair hoofddocent biologische wetenschappen aan het UB College of Arts and Sciences.
"De herhalingen die we in mucinen zien, worden 'PTS-herhalingen' genoemd vanwege hun hoge gehalte aan de aminozuren proline, threonine en serine, en ze helpen mucinen bij hun belangrijke biologische functies die variëren van het smeren en beschermen van weefseloppervlakken tot het helpen om ons voedsel glad te maken. zodat we het kunnen slikken", zegt Stefan Ruhl, DDS, Ph.D., interim-decaan van de UB School of Dental Medicine en hoogleraar orale biologie. "Heilzame microben zijn geëvolueerd om te leven op met slijm bedekte oppervlakken, terwijl slijm tegelijkertijd ook kan fungeren als een beschermende barrière en zich kan verdedigen tegen ziekten door ons te beschermen tegen ongewenste pathogene indringers."
"Niet veel mensen weten dat de eerste mucine die was gezuiverd en biochemisch gekarakteriseerd uit een speekselklier kwam", voegt Ruhl eraan toe. "Mijn laboratorium bestudeert al 30 jaar mucines in speeksel, vooral omdat ze tanden beschermen tegen tandbederf en omdat ze helpen de microbiota in de mondholte in evenwicht te brengen."
De intrigerende evolutie van een 'verbazingwekkende levenseigenschap'
"I think this paper is really interesting," Gokcumen says. "It's one of those times where we got lucky. We were studying saliva, and then we found something that's interesting and cool and decided to look into it."
While studying saliva, the team noticed that a small salivary mucin in humans called MUC7 was not present in mice. The rodents did, however, have a similarly sized salivary mucin called MUC10. The scientists wanted to know:Were these two proteins related from an evolutionary perspective?
The answer was no. But what the research uncovered next was a surprise. While MUC10 did not appear to be related to MUC7, a protein found in human tears called PROL1 did share a portion of MUC10's structure. PROL1 looked a lot like MUC10, minus the sugar-coated bottlebrush repeats that make MUC10 a mucin.
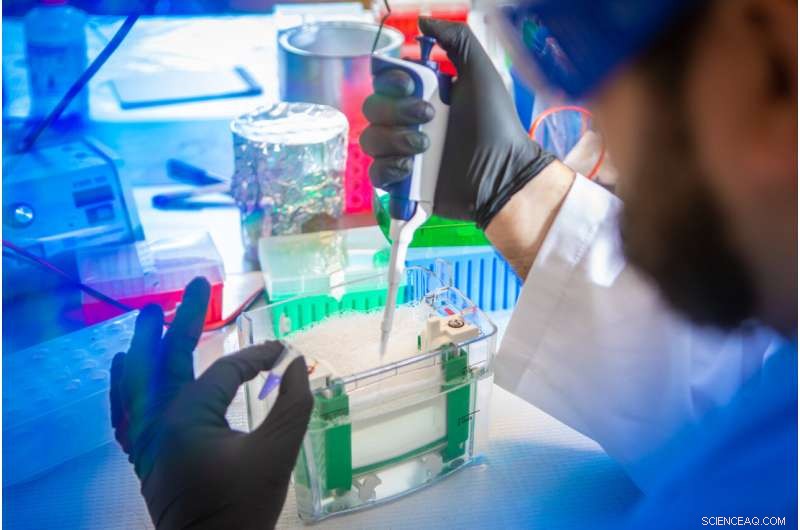
Petar Pajic, UB PhD student in biological sciences, uses a gel electrophoresis technique to separate mucins from other proteins in a saliva sample. Credit:Douglas Levere / University at Buffalo
"We think that somehow that tear gene ends up repurposed," Gokcumen says. "It gains the repeats that give it the mucin function, and it's now abundantly expressed in mouse and rat saliva."
The scientists wondered whether other mucins might have formed the same way. They began to investigate and discovered multiple examples of the same phenomena. Though many mucins share common ancestry among various groups of mammals, the team documented 15 instances in which evolution appeared to have converted non-mucin proteins into mucins via the addition of PTS repeats.
And this was "with a pretty conservative look," Gokcumen says, noting that the study focused on one region of the genome in a few dozen mammal species. He calls slime an "amazing life trait," and he's curious whether the same evolutionary mechanism might have driven the formation of some mucins in slugs, slime eels and other critters. More research is needed to find an answer.
"How new gene functions evolve is still a question we are asking today," says Pajic, a UB Ph.D. student in biological sciences. "Thus, we are adding to this discourse by providing evidence of a new mechanism, where gaining repeated sequences within a gene births a novel function."
"I think this could have even broader implications, both in understanding adaptive evolution and in possibly explaining certain disease-causing variants," Pajic adds. "If these mucins keep evolving from non-mucins over and over again in different species at different times, it suggests that there is some sort of adaptive pressure that makes it beneficial. And then, at the other end of the spectrum, maybe if this mechanism goes 'off the rails'—happening too much, or in the wrong tissue—then maybe it can lead to disease like certain cancers or mucosal illnesses."
The study on mucins demonstrates how a long-time partnership between evolutionary biologists and dental researchers at UB is yielding new insights into genes and proteins that are also important to human health.
"My team has been studying mucins for many decades, and my collaboration with Dr. Gokcumen has brought this research to a new level by revealing all these exciting novel insights into their evolutionary genetics," Ruhl says. "At this advanced stage of my career, it is also immensely gratifying to see that the flame of scientific curiosity is being carried on by a new generation of young investigators like Petar Pajic." + Verder verkennen
Contact lenses:A molecule from pig stomach mucus prevents corneal damage
 Hoe Negatieve Celsius naar Fahrenheit te converteren
Hoe Negatieve Celsius naar Fahrenheit te converteren  Video:De chemie achter brokjes
Video:De chemie achter brokjes Een vreemd fenomeen ontrafelen dat zowel de prestaties van lithium-ionbatterijen helpt als schaadt
Een vreemd fenomeen ontrafelen dat zowel de prestaties van lithium-ionbatterijen helpt als schaadt Wat is een Cul Ionische verbinding?
Wat is een Cul Ionische verbinding?  Onderzoek breekt nieuwe wegen in om te begrijpen hoe een moleculaire motor kracht genereert
Onderzoek breekt nieuwe wegen in om te begrijpen hoe een moleculaire motor kracht genereert
 De combinatie van inheemse en wetenschappelijke kennis verbetert het brandbeheer in de Sahel
De combinatie van inheemse en wetenschappelijke kennis verbetert het brandbeheer in de Sahel Onderzoeker klimaatverandering komt om bij ongeval in Groenland
Onderzoeker klimaatverandering komt om bij ongeval in Groenland Wat is het verschil tussen deflatie en zout?
Wat is het verschil tussen deflatie en zout?  MBL-team fotografeert de bacteriële lifters op plastic afval in de oceaan
MBL-team fotografeert de bacteriële lifters op plastic afval in de oceaan NASA-satellietgegevens tonen Humbertos structuurverandering
NASA-satellietgegevens tonen Humbertos structuurverandering
Hoofdlijnen
- Nieuwe functie in genregulerend eiwit ontdekt
- Hoe de lengte van DNA-fragmenten te berekenen
- Kaperparasiet geblokkeerd voor infiltratie van bloed
- Onderzoeker rapporteert belangrijke componenten van antivirale verdediging van honingbijen
- Er is een gemakkelijke manier om mitose en meiose te begrijpen
- Ja,
- Hoe komen de spermacellen in een stuifmeelkorrel aan bij de eicelklus in een plant-ovule?
- Mitzi en de gigantische haarbal
- Onderzoekers identificeren manier om malariaparasieten te verzwakken tegen populaire medicamenteuze behandelingen
- IJsbeerblogs onthullen gevaarlijke kloof tussen feiten en meningen over klimaatverandering

- Onze eerste stappen? Fossiel kan zaak voor vroegste voorouder versterken
- Passagiersduivengenoom toont effecten van natuurlijke selectie in een enorme populatie

- Een plantenceldiagram maken

- Onderzoekers ontwikkelen eerste duurzame chromosoomveranderingen bij muizen

 Het produceren van betere handleidingen voor medische beeldanalyse
Het produceren van betere handleidingen voor medische beeldanalyse Nieuwe studie onthult dat grafenen nu monolaag en enkelkristallijn worden
Nieuwe studie onthult dat grafenen nu monolaag en enkelkristallijn worden Ondersteuning stuurt het lot van beschermde gouden nanoclusters als katalysatoren
Ondersteuning stuurt het lot van beschermde gouden nanoclusters als katalysatoren In de winkelrekken:camera's die je leeftijd en geslacht raden
In de winkelrekken:camera's die je leeftijd en geslacht raden Daklozen in Delhi krijgen maskers naarmate de smog erger wordt:officieel
Daklozen in Delhi krijgen maskers naarmate de smog erger wordt:officieel Iconische plantenfamilie in gevaar:wetenschappers schatten dat meer dan de helft van de palmsoorten met uitsterven wordt bedreigd
Iconische plantenfamilie in gevaar:wetenschappers schatten dat meer dan de helft van de palmsoorten met uitsterven wordt bedreigd Emotie-leesalgoritmen kunnen geen intenties voorspellen via gezichtsuitdrukkingen
Emotie-leesalgoritmen kunnen geen intenties voorspellen via gezichtsuitdrukkingen Optische chaos gebruiken om het momentum van licht te beheersen
Optische chaos gebruiken om het momentum van licht te beheersen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

