
Wetenschap
Hergebruikt protease controleert een belangrijk signaalmolecuul-activerend eiwit

Dit proces omvat het splitsen (afstoten) van ADAM17 van de signaalmoleculen van hun voorlopervormen in het membraan van een cel. De "pseudoprotease" iRhom2 helpt bij de rijping en het transport van ADAM17. Door een gebrek aan structureel inzicht zijn de mechanismen die aan dit proces ten grondslag liggen echter onduidelijk.
Vandaag gepubliceerd in Molecular Cell hebben wetenschappers van het St. Jude Children's Research Hospital en de Universiteit van Oxford cryo-elektronenmicroscopie gebruikt om een reeks structuren van het menselijke ADAM17/iRhom2-complex in zowel de actieve als de inactieve toestand bloot te leggen. Deze structuren laten zien dat iRhom2 fungeert als poortwachter voor de levenscyclus van ADAM17 en interageert met belangrijke regio's van ADAM17 die de activiteit ervan controleren.
Het werk biedt ook potentiële mogelijkheden voor het ontwerpen van geneesmiddelen om ziekten als chronische ontstekingen en auto-immuunontregeling te bestrijden. "We denken dat er potentieel is om kleine moleculen te ontwerpen die zich rechtstreeks richten op iRhom2 in plaats van ADAM17, of op de interface tussen iRhom2 en ADAM17", zegt co-corresponderende auteur, Chia-Hsueh Lee, Ph.D., St. Jude Department of Structural Biology .
Het ter ziele gegane protease krijgt een nieuw leven
iRhom2 is een pseudoprotease:het heeft alle structurele kenmerken van een protease uit de romboïdefamilie, behalve dat het het proteasedefiniërende vermogen mist om eiwitten te splitsen. Maar net als een oude hond die nieuwe trucjes leert, speelt iRhom2 nieuwe rollen in de steigers en het transport van ADAM17.
Zoals uit structurele studies blijkt, begint de impact van iRhom2 op de ADAM17-functie tijdens de initiële synthese van de twee eiwitten. "Het endoplasmatisch reticulum is waar ADAM17 en iRhom2 worden gemaakt, en in dit stadium vormen ze een complex", legt Lee uit. iRhom2 vergemakkelijkt vervolgens het pendelen van ADAM17 naar het Golgi-apparaat voor rijping, waar het eerdere concept van iRhom2 dat slechts als een "passief schavot" diende, op de proef werd gesteld door Lee's structuren.
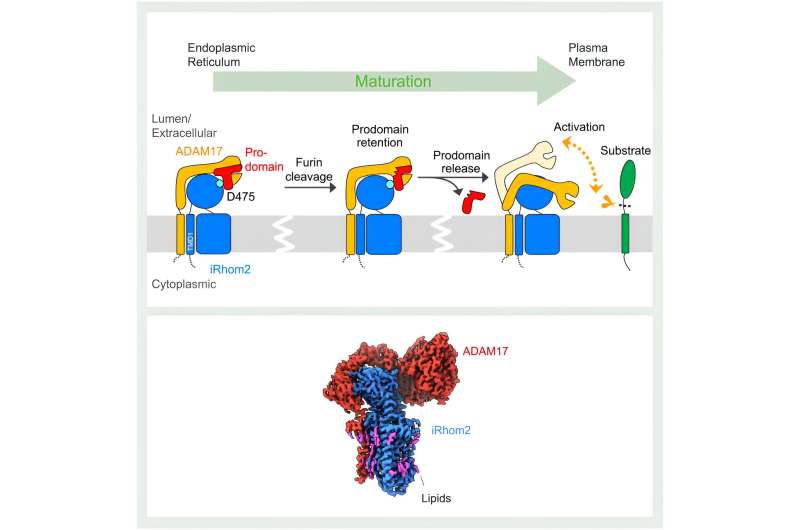
Er werd aangenomen dat de interactie tussen iRhom2 en ADAM17 uitsluitend plaatsvond tussen de transmembraandomeinen van de eiwitten, die de eiwitten aan het celmembraan vastpinnen. Tot verbazing van de onderzoekers interageren de twee eiwitten ook via hun extracellulaire gebieden. Door deze interacties houdt iRhom2 vast aan een belangrijke regio van ADAM17, het prodomein. Het prodomein is een regio die fungeert als veiligheidsspeld op een brandblusser.
"ADAM17 zelf remt zichzelf. Het heeft een prodomeinkap om zijn eigen proteaseplaats te blokkeren", legt Lee uit.
iRhom2 helpt de limiet voor ADAM17-activiteit te verlagen
Binnen het Golgi-apparaat wordt deze zelfregulerende prodomeinkap gespleten. iRhom2 behoudt echter de ADAM17-dop totdat het complex het celmembraan bereikt. Deze stap is cruciaal om de voortijdige activering van ADAM17 te voorkomen. De nieuwe structuren laten zien dat zodra de dop wordt verwijderd, ADAM17 wordt geactiveerd. Deze activering wordt gekenmerkt door een aanzienlijke winst in flexibiliteit, waardoor ADAM17 in de omringende ruimte kan zoeken naar substraten.
Er is aangetoond dat ADAM17 een rol speelt bij de ontwikkeling en progressie van meerdere soorten kanker; de ADAM-eiwitfamilie is echter goed geconserveerd. Een medicijn dat zich richt op ADAM17 kan leiden tot off-target-effecten. Lee is optimistisch dat de structuren een blauwdruk kunnen bieden voor vindingrijkheid in het ontwerpen van medicijnen.
"Als we op basis van ons model deze twee eiwitten bij elkaar zouden kunnen houden, bijvoorbeeld via een bindmiddel dat de interactie tussen iRhom2 en ADAM17 verbetert, zal iRhom2 de prodomeinkap niet vrijgeven", zegt Lee. "Dit zal de ADAM17-activiteit aanzienlijk verminderen."
De eerste auteurs van de studie zijn Fangfang Lu, Universiteit van Oxford en Hongtu Zhao, St. Jude. De andere co-corresponderende auteurs van de studie zijn Hongtu Zhao, St. Jude en Matthew Freeman, Universiteit van Oxford. De aanvullende auteurs van de studie zijn Yaxin Dai en Yingdi Wang, St. Jude.