
Wetenschap
Onderzoekers onthullen de dynamische structuur van FLVCR-eiwitten en hun functie bij het transport van voedingsstoffen
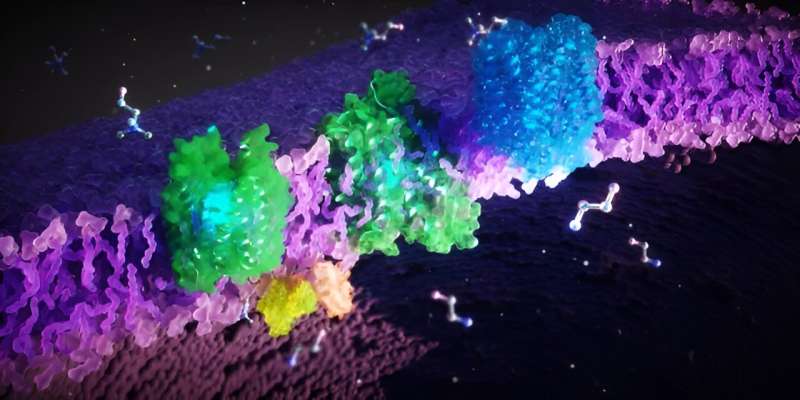
Het is bekend dat storingen in de eiwitten FLVCR1 en FLVCR2 leiden tot zeldzame erfelijke ziekten bij de mens die motorische, sensorische en neurologische aandoeningen veroorzaken. De biochemische mechanismen hierachter en de fysiologische functies van de FLVCR-eiwitten zijn tot nu toe echter onduidelijk.
Een interdisciplinair team van onderzoekers uit Frankfurt am Main, Singapore en de VS heeft nu de 3D-structuren en hun cellulaire functies van de FLVCR-eiwitten ontcijferd. De onderzoekers hebben aangetoond dat de eiwitten de cellulaire bouwstenen choline en ethanolamine transporteren. Hun bevindingen dragen aanzienlijk bij aan het begrijpen van de pathogenese van zeldzame ziekten en het ontwikkelen van nieuwe therapieën.
In tv-series van ziekenhuizen zoeken artsen naar de juiste diagnoses en mogelijke behandelingen voor patiënten met soms raadselachtige of vreemde symptomen. In werkelijkheid duurt dit proces vaak jaren voor mensen die getroffen zijn door zeldzame ziekten. In veel gevallen bestaat er geen effectieve medicatie en zijn de therapeutische mogelijkheden beperkt.
Ongeveer 6% tot 8% van de wereldbevolking lijdt aan een zeldzame ziekte. Dat zijn ongeveer 500 miljoen mensen, ook al treft elk van de ruim 7.000 verschillende ziekten slechts ongeveer 1 op de 2.000 mensen. Omdat deze ziekten zo zeldzaam zijn, is de medische en wetenschappelijke kennis erover beperkt. Wereldwijd zijn er maar een paar experts en het maatschappelijk bewustzijn ontbreekt.
Het ontrafelen van de structuur en functie van eiwitten om ziekten te begrijpen en therapieën te ontwikkelen
Een internationaal team van onderzoekers onder leiding van Schara Safarian, projectgroepleider bij het Max Planck Instituut voor Biofysica en onafhankelijk groepsleider bij het Fraunhofer Instituut voor Translationele Geneeskunde en Farmacologie ITMP, en het Instituut voor Klinische Farmacologie van de Goethe Universiteit in Frankfurt, heeft nu onderzocht de structuur en cellulaire functie van twee eiwitten, FLVCR1 en FLVCR2, die een causale rol spelen bij een aantal zeldzame erfelijke ziekten.
De wetenschappers hebben hun bevindingen gepubliceerd in Nature .
Storingen in FLVCR1 en FLVCR2 als gevolg van genmutaties veroorzaken zeldzame ziekten, waarvan sommige resulteren in ernstige visuele, mobiliteits- en sensorische stoornissen, zoals ataxie van de achterste kolom met retinitis pigmentosa, het Fowler-syndroom of sensorische en autonome neuropathieën. Dit laatste kan bijvoorbeeld leiden tot een volledig verlies van pijnsensatie.
"Bij veel ziekten, waaronder de zeldzame, zijn de celstructuren in ons lichaam veranderd en dit leidt tot storingen in biochemische processen", zegt Schara Safarian. "Om de ontwikkeling van dergelijke ziekten te begrijpen en therapieën te ontwikkelen, moeten we weten hoe deze eiwitten op moleculair niveau gestructureerd zijn en welke functies ze vervullen in gezonde cellen."
FLVCR1 en FLVCR2 transporteren de cellulaire bouwstenen choline en ethanolamine
De wetenschappers hebben ontdekt dat FLVCR 1 en FLVCR2 de moleculen choline en ethanolamine door de membranen van onze cellen transporteren. "Choline en ethanolamine zijn essentieel voor belangrijke lichaamsfuncties. Ze ondersteunen de groei, regeneratie en stabiliteit van onze cellen, bijvoorbeeld in spieren, inwendige organen en de hersenen", legt Safarian uit.
“Bovendien is choline betrokken bij de vetstofwisseling en de ontgifting door de lever. Ons lichaam heeft het ook nodig om de neurotransmitter acetylcholine aan te maken, die cruciaal is voor ons zenuwstelsel en die onze hersenen nodig hebben om de organen aan te sturen. Je kunt je dus voorstellen dat er storingen optreden. van de FLVCR-eiwitten kunnen ernstige neurologische en spieraandoeningen veroorzaken."
De onderzoekers gebruikten microscopische, biochemische en computerondersteunde methoden om de FLVCR-eiwitten te onderzoeken. "We hebben de eiwitten shockbevroren en vervolgens onder een elektronenmicroscoop bekeken", legt Di Wu, onderzoeker aan het Max Planck Instituut voor Biofysica en co-auteur van het onderzoek, uit. "Een elektronenbundel dringt door het bevroren monster en de interactie van de elektronen met het materiaal creëert een beeld."
De onderzoekers nemen veel individuele afbeeldingen, verwerken en combineren deze op een computer om 3D-structuren van eiwitten met hoge resolutie te verkrijgen. Op deze manier konden ze de structuren van FLVCR1 en FLVCR2 ontcijferen en zien hoe ze veranderen in de aanwezigheid van ethanolamine en choline. Computersimulaties bevestigden en visualiseerden hoe de FLVCR-eiwitten interageren met ethanolamine en choline, en hun structuur dynamisch veranderen om transport van voedingsstoffen mogelijk te maken.
Safarian vat samen:"Onze bevindingen maken de weg vrij voor het begrijpen van de ontwikkeling en progressie van zeldzame ziekten die verband houden met de FLVCR-eiwitten. In de toekomst kunnen patiënten mogelijk profiteren van nieuwe therapieën die hun levenskwaliteit herstellen."