Wetenschap
Hoe stresshormonen bacteriën in hun gastheer begeleiden
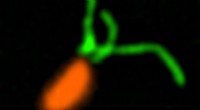
Cellen van Vibrio campbellii bewegen met behulp van lange flagellen. Krediet:Wanner/Jung, LMU
Bij mensen en dieren zijn catecholamines zoals epinefrine, norepinefrine en dopamine veel voorkomende stresshormonen. Stress kan de gevoeligheid van het lichaam voor bacteriële infecties vergroten. In het laboratorium stimuleren stresshormonen de groei van verschillende ziekteverwekkers. Dit was al waargenomen bij Salmonella (Salmonella enterica serovar Typhimurium) en andere darmbacteriën, Escherichia coli en de veroorzaker van cholera, Vibrio cholerae. Bovendien maken epinefrine en norepinefrine het voor bacteriën gemakkelijker om lichaamscellen te infecteren. En deze hormonen beïnvloeden ook de biosynthese van virulentiefactoren, waardoor ziekteverwekkers zich kunnen hechten aan cellen, deze kunnen binnendringen en vernietigen.
"We vermoedden daarom dat sommige bacteriën dergelijke hormonen gebruiken als signalen om de eukaryote gastheeromgeving te herkennen", zegt LMU-microbioloog professor Kirsten Jung. "Maar de moleculaire basis was niet bekend." Samen met professor Stephan A. Sieber van de Technische Universiteit van München (TUM) en andere onderzoekers heeft Jung nu de bindingsplaats van epinefrine en het epinefrinederivaat fenylefrine in de bacterie Vibrio campbellii geïdentificeerd. Zoals het team meldt in PNAS , het doelwit van beide moleculen is het eiwit CheW. "De biologische betekenis van het mechanisme is dat bacteriën bijvoorbeeld herkennen dat ze niet meer in zeewater zitten, maar in de darm van een gastheer", legt Jung uit.
Studies met het modelorganisme V. campbellii
"We wilden weten hoe bacteriën catecholamines herkennen als signaalmoleculen", zegt de LMU-wetenschapper. "Welke receptoren regelen dit proces?" Haar experimenten bestonden uit verschillende afzonderlijke stappen.
Voor het onderzoek ontwikkelde Sieber een methode om epinefrine en fenylefrine chemisch te modificeren, zodat de onderzoekers complexen direct konden isoleren van de catecholamines en de gebonden bacteriële eiwitten. Voorwaarde van de experimenten was dat de nieuwe verbindingen geen biologische eigenschappen zouden hebben die de ongewijzigde moleculen niet hadden. De groep van Jung deed laboratoriumexperimenten om aan te tonen dat dit zo was. Epinefrine bindt ijzer, terwijl het epinefrinederivaat fenylefrine dat niet doet. Met hun keuze van verbindingen wilden de onderzoekers effecten uitsluiten die ontstaan wanneer de bacteriën een betere aanvoer van ijzer hebben.
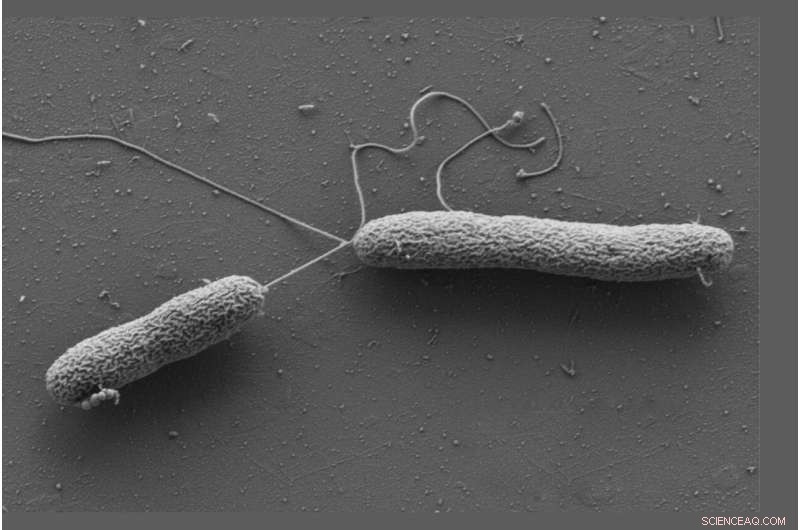
Jung en Sieber werkten met Vibrio campbellii als modelorganisme. De mariene bacterie infecteert vissen, garnalen, inktvissen en vele andere ongewervelde zeedieren. Ze voegden Vibrio campbellii toe aan de chemisch gemodificeerde catecholamines en lyseerden de cellen. Vervolgens extraheren ze uit het lysaat alle eiwitten waaraan een molecuul was gebonden en karakteriseerden ze met behulp van proteoomanalyse. Dit resulteerde in een bijzondere verrijking van het oplosbare chemotaxis-eiwit CheW.
Vervolgens isoleerde de groep van Jung het CheW-eiwit rechtstreeks uit bacteriën, zuiverde het en mat de bindingsaffiniteit voor catecholamines. Daarbij ontdekten de onderzoekers iets verrassends:de hormonen binden zich niet aan de chemoreceptoren zelf, zoals oorspronkelijk verwacht, maar aan het koppelingseiwit CheW, dat zich tussen receptoren en een signaaltransductiecascade bevindt. Dit hele stimulusperceptiesysteem regelt de beweging van de bacterie in een chemische gradiënt.
"Onze studie biedt nieuwe inzichten in de communicatie van bacteriën met hun gastheer", vat Jung samen. "We konden aantonen dat het zwemgedrag van bacteriën wordt gewijzigd door gastheerhormonen, die worden gecontroleerd door CheW." Motiliteit, en in het bijzonder gerichte motiliteit, is van doorslaggevend belang voor gastheerkolonisatie, aangezien bacteriën opzettelijk een organisme proberen te koloniseren en alle niches veroveren. In de volgende stap wil Jung nu uitzoeken of hetzelfde mechanisme bij andere bacteriën kan worden aangetoond.
 Bakoliecoating voorkomt dat bacteriën groeien op voedselverwerkende apparatuur
Bakoliecoating voorkomt dat bacteriën groeien op voedselverwerkende apparatuur Wat zijn oxidanten?
Wat zijn oxidanten?  Duurzame chemische synthese met platina
Duurzame chemische synthese met platina Cranberry-oligosachariden kunnen urineweginfecties helpen voorkomen
Cranberry-oligosachariden kunnen urineweginfecties helpen voorkomen Gedetailleerde foto laat zien hoe tandglazuur sterk genoeg is om een leven lang mee te gaan
Gedetailleerde foto laat zien hoe tandglazuur sterk genoeg is om een leven lang mee te gaan
 Decadale klimaatvariabiliteit in de tropische Stille Oceaan
Decadale klimaatvariabiliteit in de tropische Stille Oceaan Matige aardbeving schommelt Bali, minstens 3 . doden
Matige aardbeving schommelt Bali, minstens 3 . doden Marshalleilanden overwegen radicale maatregelen om stijgende zeespiegel te overleven
Marshalleilanden overwegen radicale maatregelen om stijgende zeespiegel te overleven New Englands 1816 Makreeljaar en klimaatverandering vandaag
New Englands 1816 Makreeljaar en klimaatverandering vandaag Dekgewassenmengsels moeten op de boerderij worden afgestemd om maximale ecosysteemdiensten te leveren
Dekgewassenmengsels moeten op de boerderij worden afgestemd om maximale ecosysteemdiensten te leveren
Hoofdlijnen
- Wat gebeurt er met een diercel wanneer deze zich in een hypotone oplossing bevindt?
- Hoe de dalingssnelheid te berekenen
- Veel dierenartsen praten niet graag over dikke katten
- Hoe de percentages van adenine in een DNA-streng te berekenen
- Beperkingen Enzymen die worden gebruikt in DNA-vingerafdrukken
- Berekening van de tijd voor celverdubbeling
- Hoeveel chromosomen zijn er in cellen van het menselijk lichaam?
- Hoe beïnvloeden Genotype en Fenotype hoe je eruit ziet?
- Moet het houden van reptielen en amfibieën als huisdier worden beperkt?
 Wat zijn enkele real-life toepassingen van trigonometrie?
Wat zijn enkele real-life toepassingen van trigonometrie?  Hoe Horns & Wasps te identificeren in Tennessee
Hoe Horns & Wasps te identificeren in Tennessee Wetenschapsexperiment voor het testen van elektrolyteniveaus in sportdranken
Wetenschapsexperiment voor het testen van elektrolyteniveaus in sportdranken Koolstof nanobuisjes voor moleculaire magnetische resonanties
Koolstof nanobuisjes voor moleculaire magnetische resonanties Hoe de straal van een boog te vinden
Hoe de straal van een boog te vinden  Honden kunnen sporen van benzine detecteren tot een miljardste theelepel
Honden kunnen sporen van benzine detecteren tot een miljardste theelepel Wat de wetenschap ons vertelt over de voor- en nadelen van knorren bij tennis
Wat de wetenschap ons vertelt over de voor- en nadelen van knorren bij tennis Radicale stappen naar schone inkapseling
Radicale stappen naar schone inkapseling
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com