
Wetenschap
Hoe een bodemmicrobe kunstmatige fotosynthese kan stimuleren
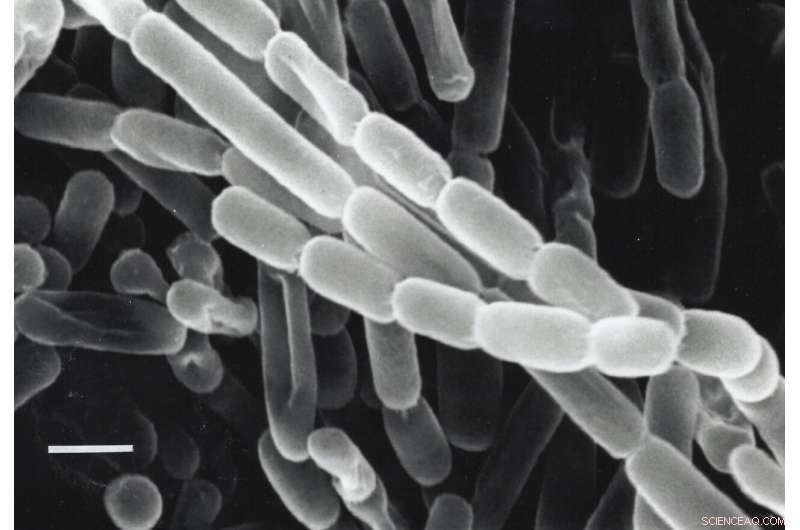
Een close-up van Kitasatospora setae, een bacterie geïsoleerd uit de bodem in Japan. Deze bacteriën fixeren koolstof - zetten koolstofdioxide uit hun omgeving om in biomoleculen die ze nodig hebben om te overleven - dankzij enzymen die ECR's worden genoemd. Onderzoekers zijn op zoek naar manieren om ECR's te gebruiken en te verbeteren voor kunstmatige fotosynthese om brandstoffen, antibiotica en andere producten te produceren. Krediet:Y. Takahashi &Y. Iwai
Planten vertrouwen voor hun bestaan op een proces dat koolstoffixatie wordt genoemd, waarbij koolstofdioxide uit de lucht wordt omgezet in koolstofrijke biomoleculen. Dat is het hele punt van fotosynthese, en een hoeksteen van het enorme in elkaar grijpende systeem dat koolstof door planten, dieren, microben en de atmosfeer laat circuleren om het leven op aarde in stand te houden.
Maar de koolstoffixerende kampioenen zijn geen planten, maar bodembacteriën. Sommige bacteriële enzymen voeren een belangrijke stap in koolstoffixatie 20 keer sneller uit dan plantenenzymen, en uitzoeken hoe ze dit doen, zou wetenschappers kunnen helpen vormen van kunstmatige fotosynthese te ontwikkelen om het broeikasgas om te zetten in brandstoffen, meststoffen, antibiotica en andere producten.
Nu heeft een team van onderzoekers van het SLAC National Accelerator Laboratory van het Department of Energy, Stanford University, Max Planck Institute for Terrestrial Microbiology in Duitsland, DOE's Joint Genome Institute (JGI) en de University of Concepción in Chili ontdekt hoe een bacterieel enzym - een moleculaire machine die chemische reacties mogelijk maakt - draait op om deze prestatie te leveren.
In plaats van kooldioxidemoleculen te grijpen en ze één voor één aan biomoleculen te hechten, ontdekten ze dat dit enzym bestaat uit paren moleculen die synchroon werken, zoals de handen van een jongleur die tegelijkertijd ballen gooit en vangt, om de klus sneller te klaren . Eén lid van elk enzympaar gaat wijd open om een reeks reactie-ingrediënten op te vangen, terwijl de andere over de gevangen ingrediënten sluit en de koolstoffixerende reactie uitvoert; dan wisselen ze van rol in een continue cyclus.
Een enkele plek van moleculaire "lijm" houdt elk paar enzymatische handen bij elkaar, zodat ze elkaar op een gecoördineerde manier kunnen openen en sluiten, ontdekte het team, terwijl een draaiende beweging ingrediënten en afgewerkte producten helpt in en uit de zakken te duwen waar de reacties spelen zich af. Wanneer zowel lijm als twist aanwezig zijn, gaat de koolstoffixerende reactie 100 keer sneller dan zonder.
"Dit bacteriële enzym is de meest efficiënte koolstoffixer die we kennen, en we kwamen met een nette uitleg van wat het kan doen", zegt Soichi Wakatsuki, een professor aan SLAC en Stanford en een van de senior leiders van de studie, die werd gepubliceerd in ACS Central Science deze week.
"Sommige enzymen in deze familie werken langzaam maar op een zeer specifieke manier om slechts één product te produceren," zei hij. "Anderen zijn veel sneller en kunnen chemische bouwstenen maken voor allerlei producten. Nu we het mechanisme kennen, kunnen we enzymen ontwikkelen die de beste eigenschappen van beide benaderingen combineren en heel snel werken met allerlei soorten uitgangsmaterialen."
De natuur verbeteren
Het enzym dat het team bestudeerde, maakt deel uit van een familie die enoyl-CoA-carboxylasen/reductasen of ECR's wordt genoemd. Het komt van bodembacteriën genaamd Kitasatospora setae, die naast hun koolstofbindende vaardigheden ook antibiotica kunnen produceren.
Wakatsuki hoorde een half dozijn jaar geleden over deze enzymfamilie van Tobias Erb van het Max Planck Instituut voor Terrestrische Microbiologie in Duitsland en Yasuo Yoshikuni van JGI. Het onderzoeksteam van Erb had gewerkt aan de ontwikkeling van bioreactoren voor kunstmatige fotosynthese om koolstofdioxide (CO2 om te zetten) ) van de atmosfeer naar allerlei producten.
Hoe belangrijk fotosynthese ook is voor het leven op aarde, zei Erb, het is niet erg efficiënt. Zoals alle dingen die door de eeuwen heen zijn gevormd door evolutie, is het alleen zo goed als het moet zijn, het resultaat van langzaam voortbouwen op eerdere ontwikkelingen, maar nooit iets geheel nieuws helemaal opnieuw uitvinden.
Wat meer is, zei hij, de stap in natuurlijke fotosynthese die CO2 . fixeert uit de lucht, dat afhankelijk is van een enzym dat Rubisco wordt genoemd, is een knelpunt dat de hele keten van fotosynthetische reacties verstoort. Dus het gebruik van snelle ECR-enzymen om deze stap uit te voeren en ze te ontwikkelen om nog sneller te gaan, zou een grote boost in efficiëntie kunnen opleveren.
"We proberen geen kopie van fotosynthese te maken," legde Erb uit. "We willen een proces ontwerpen dat veel efficiënter is door onze kennis van techniek te gebruiken om de concepten van de natuur te herbouwen. Deze 'fotosynthese 2.0' zou kunnen plaatsvinden in levende of synthetische systemen zoals kunstmatige chloroplasten - waterdruppels gesuspendeerd in olie."
Portretten van een enzym
Wakatsuki en zijn groep hadden een gerelateerd systeem onderzocht, stikstoffixatie, dat stikstofgas uit de atmosfeer omzet in verbindingen die levende wezens nodig hebben. Geïntrigeerd door de vraag waarom ECR-enzymen zo snel waren, begon hij samen te werken met de groep van Erb om antwoorden te vinden.
Hasan DeMirci, een onderzoeksmedewerker in de Wakatsuki-groep die nu een assistent-professor is aan de Koc University en onderzoeker bij het Stanford PULSE Institute, leidde de inspanning bij SLAC met hulp van een half dozijn SLAC-zomerstagiairs die hij begeleidde. "We trainen er zes of zeven per jaar en ze waren onverschrokken", zei hij. "Ze kwamen met een open geest, leergierig en deden geweldige dingen."
Het SLAC-team maakte monsters van het ECR-enzym en kristalliseerde ze voor onderzoek met röntgenstralen bij de Advanced Photon Source in het Argonne National Laboratory van DOE. De röntgenfoto's onthulden de moleculaire structuur van het enzym - de rangschikking van zijn atomaire steiger - zowel op zichzelf als wanneer het is bevestigd aan een klein hulpmolecuul dat zijn werk vergemakkelijkt.
Verdere röntgenonderzoeken bij SLAC's Stanford Synchrotron Radiation Lightsource (SSRL) toonden aan hoe de structuur van het enzym verschoof wanneer het zich hechtte aan een substraat, een soort moleculaire werkbank die ingrediënten voor de koolstoffixerende reactie verzamelt en de reactie stimuleert.
Ten slotte voerde een team van onderzoekers van SLAC's Linac Coherent Light Source (LCLS) meer gedetailleerde studies uit van het enzym en zijn substraat bij de Japanse SACLA X-ray free-electron laser. De keuze voor een röntgenlaser was belangrijk omdat ze het gedrag van het enzym bij kamertemperatuur konden bestuderen - dichter bij zijn natuurlijke omgeving - met bijna geen stralingsschade.
Ondertussen hebben de groep van Erb in Duitsland en de groep van universitair hoofddocent Esteban Vöhringer-Martinez aan de Universiteit van Concepción in Chili gedetailleerde biochemische studies en uitgebreide dynamische simulaties uitgevoerd om de structurele gegevens die door Wakatsuki en zijn team zijn verzameld te begrijpen.

Deze afbeelding van ECR, een enzym dat wordt aangetroffen in bodembacteriën, toont elk van de vier identieke moleculen in een andere kleur. Deze moleculen werken in paren samen - blauw met wit en groen met oranje - om koolstofdioxide uit de omgeving van de microbe om te zetten in biomoleculen die het nodig heeft om te overleven. Een nieuwe studie toont aan dat een beetje moleculaire lijm en een tijdige swing en twist deze paren in staat stellen hun bewegingen te synchroniseren en koolstof 20 keer sneller te fixeren dan plantenenzymen tijdens fotosynthese. Krediet:H. DeMirci et al
De simulaties onthulden dat het openen en sluiten van de twee delen van het enzym niet alleen moleculaire lijm omvat, maar ook draaiende bewegingen rond de centrale as van elk enzympaar, zei Wakatsuki.
"Deze draai is bijna als een ratel die een afgewerkt product naar buiten kan duwen of een nieuwe set ingrediënten in de zak kan trekken waar de reactie plaatsvindt," zei hij. Samen zorgen de verdraaiing en synchronisatie van de enzymparen ervoor dat ze 100 keer per seconde koolstof kunnen fixeren.
De ECR-enzymfamilie omvat ook een meer veelzijdige tak die kan interageren met veel verschillende soorten biomoleculen om een verscheidenheid aan producten te produceren. Maar omdat ze niet bij elkaar worden gehouden door moleculaire lijm, kunnen ze hun bewegingen niet coördineren en werken daarom veel langzamer.
"Als we de snelheid van die geavanceerde reacties kunnen verhogen om nieuwe biomoleculen te maken," zei Wakatsuki, "zou dat een aanzienlijke sprong in het veld zijn."
Van statische opnamen tot vloeiende films
Tot nu toe hebben de experimenten statische snapshots opgeleverd van het enzym, de reactie-ingrediënten en de eindproducten in verschillende configuraties.
"Ons droomexperiment," zei Wakatsuki, "zou zijn om alle ingrediënten te combineren terwijl ze in het pad van de röntgenlaserstraal stromen, zodat we de reactie in realtime kunnen zien plaatsvinden."
Het team heeft dat bij SACLA ook geprobeerd, zei hij, maar het werkte niet. "De CO2 moleculen zijn erg klein, en ze bewegen zo snel dat het moeilijk is om het moment te vangen waarop ze zich hechten aan het substraat," zei hij. "Bovendien is de röntgenlaserstraal zo sterk dat we de ingrediënten er niet lang in konden houden genoeg om de reactie te laten plaatsvinden. Toen we hier hard op drukten, slaagden we erin de kristallen te breken."
Een aanstaande high-energy upgrade naar LCLS zal dat probleem waarschijnlijk oplossen, voegde hij eraan toe, met pulsen die veel vaker binnenkomen - een miljoen keer per seconde - en individueel kunnen worden aangepast aan de ideale sterkte voor elk monster.
Wakatsuki zei dat zijn team blijft samenwerken met de groep van Erb, en dat het samenwerkt met de LCLS-monsterafleveringsgroep en met onderzoekers van de SLAC-Stanford cryogene elektronenmicroscopie (cryo-EM) faciliteiten om een manier te vinden om deze aanpak te laten werken.
 Warmteopslag:wetenschappers ontwikkelen materiaal dat stabiel, efficiënt en milieuvriendelijk is
Warmteopslag:wetenschappers ontwikkelen materiaal dat stabiel, efficiënt en milieuvriendelijk is Stabiliserend molecuul kan de weg vrijmaken voor lithium-luchtbrandstofcel
Stabiliserend molecuul kan de weg vrijmaken voor lithium-luchtbrandstofcel Computationele origami:een universele methode om 3D-gebogen oppervlakken te omwikkelen met niet-rekbare materialen
Computationele origami:een universele methode om 3D-gebogen oppervlakken te omwikkelen met niet-rekbare materialen Superdichte pakking van waterstofmoleculen op een oppervlak
Superdichte pakking van waterstofmoleculen op een oppervlak Drukken maakt polymeren plat, verbetering van elektrische en optische eigenschappen
Drukken maakt polymeren plat, verbetering van elektrische en optische eigenschappen
 Luchtvervuiling maakt ons misschien minder intelligent
Luchtvervuiling maakt ons misschien minder intelligent Klimaatverandering verandert bomen in veelvraat
Klimaatverandering verandert bomen in veelvraat NASA krijgt een diepgaande kijk op de intensivering van de orkaan Harvey
NASA krijgt een diepgaande kijk op de intensivering van de orkaan Harvey Klimaatactie kan niet wachten tot de pandemie stopt, medische tijdschriften waarschuwen
Klimaatactie kan niet wachten tot de pandemie stopt, medische tijdschriften waarschuwen 5, 000 Dieselgate-sterfgevallen in Europa per jaar:studie
5, 000 Dieselgate-sterfgevallen in Europa per jaar:studie
Hoofdlijnen
- Wat is het Malthusiaanse uitgangspunt?
- Biologen ontdekken genetische routes die het immuunsysteem en de bloedsomloop van muggen tijdens infectie met elkaar verbinden
- Wat zijn enkele materialen die ik zou kunnen gebruiken om plantencellen te maken?
- Wetenschappers identificeren nieuwe gastheren voor vectoren van de ziekte van Chagas
- Het geheim van een lang leven? Vraag een geelbuikmarmot
- Wat is osmotische lyse?
- Onderzoekers ontdekken nieuwe veeziekte en voorkomen dat deze zich verspreidt
- Waarom Afrikaanse wetenschappers de genen van Afrikaanse soorten bestuderen en hoe ze dat doen
- Feiten over lipiden
- Evolutionair gewasonderzoek:Egoplanten geven lagere opbrengst

- Dawn of fishes:vroeg-silurische kaken van gewervelde dieren van kop tot staart onthuld

- Verrassend onderzoek bij apen vindt dat slechte tijden er niet toe leiden dat groepsleden hun gedrag veranderen

- Wetenschappers maken een einde aan een mysterie van 50 jaar en onthullen hoe bacteriën zich kunnen verplaatsen
- Uit onderzoek blijkt dat de afkoeling van de oceaan gedurende millennia heeft geleid tot grotere vissen

 Uber koopt Midden-Oosten rivaal Careem:rapport
Uber koopt Midden-Oosten rivaal Careem:rapport De wereld wordt geconfronteerd met een wereldwijde zandcrisis
De wereld wordt geconfronteerd met een wereldwijde zandcrisis Nieuw commentaar op het beroemde artikel Warning to Humanity brengt wereldwijde ongelijkheden aan het licht
Nieuw commentaar op het beroemde artikel Warning to Humanity brengt wereldwijde ongelijkheden aan het licht Geen manier om explosie in chemische fabriek in Texas te voorkomen
Geen manier om explosie in chemische fabriek in Texas te voorkomen NASA-wetenschappers maken gebruik van koolstofmeetinstrument voor Mars-onderzoeken
NASA-wetenschappers maken gebruik van koolstofmeetinstrument voor Mars-onderzoeken Welke roofdieren eten het wandelstokinsect?
Welke roofdieren eten het wandelstokinsect?  Wat is ASMR (en werkt het echt?)
Wat is ASMR (en werkt het echt?)  Spin-on-perovskietonderzoek vergroot het potentieel voor kwantumcomputers
Spin-on-perovskietonderzoek vergroot het potentieel voor kwantumcomputers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

