
Wetenschap
Hoe een ongevaarlijke omgevingsbacterie de gevreesde ziekenhuiskiem Acinetobacter baumannii werd
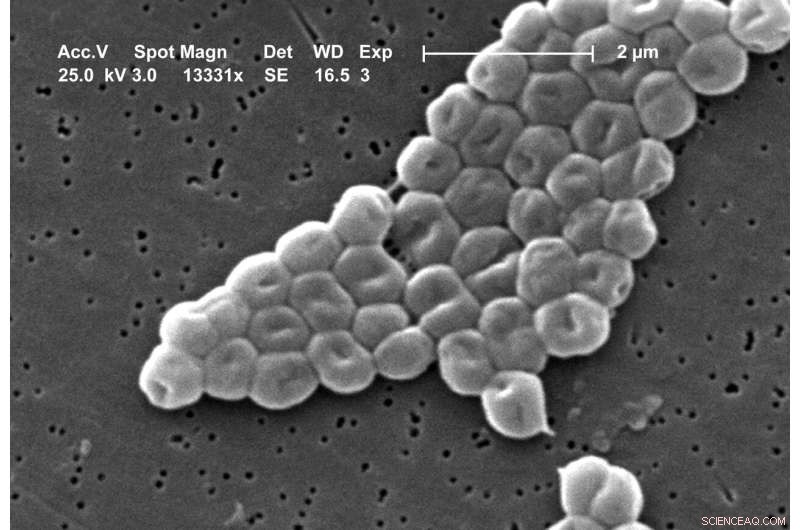
Scanning-elektronenmicrofoto van een cluster van Gram-negatieve, immobiele bacteriën van de Acinetobacter baumannii-soort. Credit:Janice Carr, CDC's Public Health Image Library Image #6498
Elk jaar worden meer dan 670.000 mensen in Europa ziek door pathogene bacteriën die resistentie tegen antibiotica vertonen, en 33.000 sterven aan de ziekten die ze veroorzaken. Vooral gevreesd zijn ziekteverwekkers die resistent zijn tegen meerdere antibiotica tegelijk. Onder hen is de bacterie Acinetobacter baumannii, die tegenwoordig vooral wordt gevreesd als een 'superbug in het ziekenhuis'. Tot vijf procent van alle in het ziekenhuis opgelopen bacteriële infecties wordt alleen door deze kiem veroorzaakt.
A. baumannii staat bovenaan een lijst van kandidaten waarvoor volgens de Wereldgezondheidsorganisatie (WHO) nieuwe therapieën moeten worden ontwikkeld. Dit komt omdat de ziekteverwekker - dankzij een flexibel genoom - gemakkelijk nieuwe antibioticaresistentie verwerft. Tegelijkertijd komen infecties niet alleen steeds meer voor buiten de ziekenhuisomgeving, maar leiden ze ook tot een steeds ernstiger progressie. Een voorwaarde voor de ontwikkeling van nieuwe therapeutische benaderingen is echter dat we begrijpen welke eigenschappen A. baumannii en zijn menselijke pathogene verwanten, gegroepeerd in wat bekend staat als het Acinetobacter calcoaceticus-baumannii (ACB) -complex, een pathogeen maken.
Een team onder leiding van bio-informaticus professor Ingo Ebersberger van de Goethe University Frankfurt/LOEWE Center for Translational Biodiversity Genomics (LOEWE-TBG) heeft nu een mijlpaal bereikt in dit inzicht. Het team bestaat uit leden van onderzoekseenheid 2251 van de Duitse onderzoeksstichting en andere nationale en internationale partners, waaronder wetenschappers van de Washington University School of Medicine, St. Louis, VS.
Voor hun analyse maakte het team gebruik van het feit dat een groot deel van de leden van het geslacht Acinetobacter onschadelijke omgevingsbacteriën zijn die in water of op planten of dieren leven. Duizenden volledige genoomsequenties, zowel van deze als van pathogene Acinetobacter-stammen, worden opgeslagen in openbaar toegankelijke databases.
Door deze genomen te vergelijken, konden de onderzoekers systematisch de verschillen tussen de pathogene en de onschadelijke bacteriën wegfilteren. Omdat de incidentie van individuele genen niet bijzonder overtuigend was, concentreerden Ebersberger en zijn collega's zich op genclusters, dat wil zeggen groepen naburige genen die tijdens de evolutie stabiel zijn gebleven en een functionele eenheid zouden kunnen vormen. "Van deze evolutionair stabiele genclusters hebben we er 150 geïdentificeerd die aanwezig zijn in pathogene Acinetobacter-stammen en zeldzaam of afwezig zijn in hun niet-pathogene verwanten", vat Ebersberger samen. "Het is zeer waarschijnlijk dat deze genclusters de overleving van de ziekteverwekkers in de menselijke gastheer ten goede komen."
Een van de belangrijkste eigenschappen van pathogenen is hun vermogen om beschermende biofilms te vormen en om micronutriënten zoals ijzer en zink efficiënt te absorberen. En inderdaad, de onderzoekers ontdekten dat de opnamesystemen in de ACB-groep een versterking waren van het bestaande en evolutionaire oudere opnamemechanisme.
Bijzonder spannend is het feit dat de ziekteverwekkers blijkbaar een speciale energiebron hebben aangeboord:ze kunnen het door de mens geproduceerde koolhydraat kynurenine afbreken, dat als boodschapperstof het aangeboren immuunsysteem reguleert. De bacterie slaat op deze manier blijkbaar twee vliegen in één klap. Aan de ene kant levert het afbreken van kynurenine hen energie en aan de andere kant kunnen ze het mogelijk gebruiken om de immuunrespons van de gastheer te dereguleren.
Ebersberger is ervan overtuigd:"Ons werk is een mijlpaal om te begrijpen wat er anders is aan pathogene Acinetobacter baumannii. Onze gegevens zijn van zo'n hoge resolutie dat we zelfs naar de situatie in individuele stammen kunnen kijken. Deze kennis kan nu worden gebruikt om specifieke therapieën te ontwikkelen tegen die naar alle waarschijnlijkheid nog niet bestaat."
Hun studie is gepubliceerd in PLOS Genetics .
 Duurzame pelletproductie redt levens
Duurzame pelletproductie redt levens Zeldzame aardelementen ontdekt in kaolienmijnen in Georgia, studie vondsten
Zeldzame aardelementen ontdekt in kaolienmijnen in Georgia, studie vondsten Vleermuizen hangen waar ooit Israëlische soldaten stonden in de Jordaanvallei
Vleermuizen hangen waar ooit Israëlische soldaten stonden in de Jordaanvallei Zijn verhoogde niveaus van kwik in de Amerikaanse dipper te wijten aan run-of-river dammen?
Zijn verhoogde niveaus van kwik in de Amerikaanse dipper te wijten aan run-of-river dammen? 13 grote bedrijven dringen er bij Trump op aan om in Parijs-deal te blijven
13 grote bedrijven dringen er bij Trump op aan om in Parijs-deal te blijven
Hoofdlijnen
- Niet alle dieren in het wild zijn hersteld in lockdowns, zo blijkt uit nieuw onderzoek
- Over de zes koninkrijken
- Feiten over osmose voor kinderen
- Voor het eerst hebben wetenschappers levende bacteriën rechtstreeks waargenomen in poolijs en sneeuw
- Hoe het eerste katachtige sabeltandroofdier werd ontdekt en waarom het verschilt van moderne katten
- Hoe erg is zwarte schimmel,
- Duizenden foto's gemaakt door gewone Australiërs onthullen de geheimen van ons onderwaterleven terwijl de oceanen warm zijn
- Nidovirussen brengen overtollig genen tot expressie en coderen voor meer eiwitten dan eerder werd aangenomen, studie vondsten
- Haaien op de kaart zetten:een nieuwe standaard om belangrijke habitats te identificeren
- Chemische cocktail in de huid roept ziekteverspreidende muggen op

- Onderzoekers brengen dramatische achteruitgang in genetische diversiteit van noordwestelijke zalm in kaart

- Trucs voor het onthouden van dierenfylum

- Gemakkelijke manieren om botten te herkennen in anatomie
- De elanden hoeden? Letse symbolische blauwe koe terug van de rand

 Natuurkundigen halen goud uit neutronensterren na meting van lood
Natuurkundigen halen goud uit neutronensterren na meting van lood Afbeelding:De maan in 1992
Afbeelding:De maan in 1992 Oud DNA laat zien dat de Sami en Finnen identieke Siberische genen delen
Oud DNA laat zien dat de Sami en Finnen identieke Siberische genen delen Ophoping van plastic in diepzee door troebelheidsstromen:NW Zuid-Chinese zee
Ophoping van plastic in diepzee door troebelheidsstromen:NW Zuid-Chinese zee Nanotech wondgenezing bij diabetes
Nanotech wondgenezing bij diabetes Een liefdesbrief aan Auburn, My Darling Final Four Pick
Een liefdesbrief aan Auburn, My Darling Final Four Pick Complexe problemen oplossen met de snelheid van het licht
Complexe problemen oplossen met de snelheid van het licht Onderzoekers bouwen een diode met één molecuul
Onderzoekers bouwen een diode met één molecuul
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

