
Wetenschap
Parasiteonderzoekers smelten eiwitten om hun rol bij infectie te begrijpen
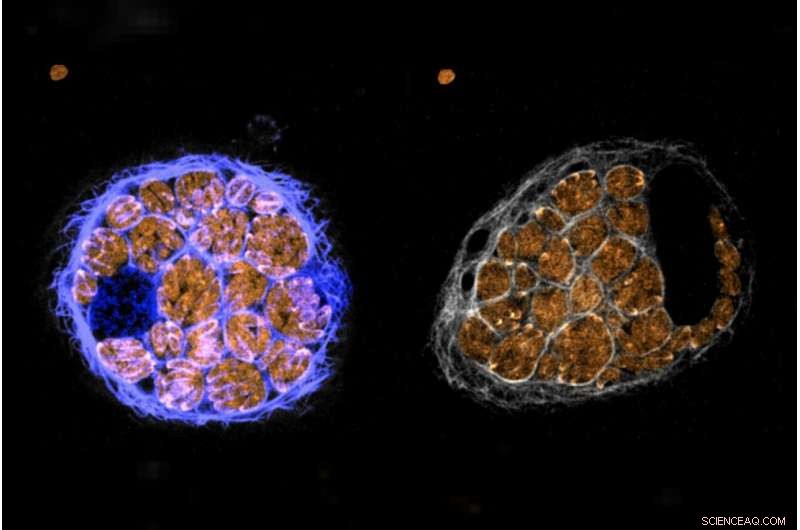
Parasieten met een marker van PP1 halen een gastheercel in. Krediet:Alice Herneisen/Whitehead Institute
Net als mensen, planten en bacteriën gebruikt de eencellige parasiet Toxoplasma gondii (T. gondii) calcium als boodschapper om belangrijke cellulaire processen te coördineren. Maar hoewel de boodschapper hetzelfde is, verschillen de communicatieroutes die zich rond calcium vormen aanzienlijk tussen organismen.
"Omdat Toxoplasma-parasieten zo afwijken van ons, hebben ze hun eigen sets eiwitten ontwikkeld die betrokken zijn bij calciumsignaleringsroutes", zegt Alice Herneisen, een afgestudeerde student in het laboratorium van Whitehead Institute-lid Sebastian Lourido.
Lourido en zijn laboratorium bestuderen de moleculaire mechanismen die ervoor zorgen dat de eencellige parasiet T. gondii en verwante pathogenen zo wijdverspreid en potentieel dodelijk zijn - en calciumsignalering is een belangrijk onderdeel van het proces van de parasiet om zijn gastheren binnen te vallen. "Calcium regelt deze zeer belangrijke overgang van de parasieten die zich in gastheercellen repliceren naar parasieten die die cellen verlaten en op zoek gaan naar nieuwe om te infecteren," zei Lourido. "We zijn erg geïnteresseerd in hoe calcium een rol speelt bij de regulatie van eiwitten in de parasiet."
Een paper gepubliceerd op 17 augustus in eLife geeft enig inzicht. In het artikel gebruikten Herneisen, Lourido en medewerkers een benadering genaamd thermische profilering om in grote lijnen te onderzoeken welke parasieteiwitten betrokken zijn bij calciumsignalering in T. gondii. Het nieuwe werk onthult dat een onverwacht eiwit een rol speelt in de calciumroutes van parasieten en nieuwe doelen biedt die wetenschappers mogelijk kunnen gebruiken om de verspreiding van de parasiet te stoppen. De gegevens zullen ook dienen als een bron die andere Toxoplasma-onderzoekers kunnen gebruiken om uit te zoeken of hun eigen interessante eiwitten interageren met calciumroutes in parasietcellen.
De verwarming staat aan
Bij het bestuderen van calciumroutes bij mensen kunnen onderzoekers vaak parallellen trekken uit werk bij muizen. "Maar parasieten zijn heel anders dan wij", zei Lourido. "Alle principes die we hebben geleerd over calciumsignalering bij mensen of muizen, kunnen niet gemakkelijk worden vertaald naar parasieten."
Om deze mechanismen in Toxoplasma te bestuderen, moesten de onderzoekers dus helemaal opnieuw beginnen om te bepalen welke eiwitten daarbij betrokken waren. Dat is waar de thermische profileringsmethode om de hoek kwam kijken. De methode is gebaseerd op de observatie dat eiwitten zijn ontworpen om goed te werken bij specifieke temperaturen, en als het te heet voor ze wordt, smelten ze. Denk aan eieren:wanneer de eiwitten in eiwitten en eidooiers worden verwarmd in een koekenpan, beginnen de eiwitten te smelten en te stollen. "Als we denken aan het smelten van een eiwit, bedoelen we dat de eiwitten zich ontrafelen", zei Lourido. "Wanneer eiwitten ontrafelen, leggen ze zijketens bloot die aan elkaar binden. Ze zijn niet langer individuele eiwitten die goed gevouwen zijn en worden een gaas."
Kleine veranderingen in de chemische structuur van een eiwit, zoals de veranderingen die het gevolg zijn van het binden van een klein molecuul zoals calcium, kunnen het smeltpunt van een eiwit veranderen. Onderzoekers kunnen deze veranderingen vervolgens traceren met behulp van proteomische methoden. "Eiwitten die calcium binden, veranderen als reactie op calcium en veranderen uiteindelijk hun thermische stabiliteit," zei Herneisen. "Dat is een beetje de taal van eiwitten, veranderingen in hun thermische stabiliteit."
De thermische profileringsmethode werkt door warmte toe te passen op parasietcellen en uit te tekenen hoe elk van de eiwitten van de parasiet reageert op temperatuurveranderingen onder verschillende omstandigheden (bijvoorbeeld de aan- of afwezigheid van calcium). In een paper uit 2020 gebruikten de onderzoekers de thermische profileringsmethode om de rol van een eiwit genaamd ENH1 in calciumsignalering te onderzoeken.
In hun nieuwe paper onderzochten Lourido en Herneisen het effect van calcium op alle eiwitten in de parasiet met behulp van twee benaderingen. De onderzoekers combineerden parasieten met specifieke hoeveelheden calcium, pasten warmte toe en voerden vervolgens proteomics-technieken uit om te volgen hoe het calcium het smeltgedrag van elk eiwit beïnvloedde. Als het smeltpunt van een eiwit hoger of lager was dan normaal, konden de onderzoekers afleiden dat dat eiwit werd veranderd door calcium zelf of door een andere speler in een calciumsignaleringsroute.
Vervolgens behandelden ze de parasieten met een chemische stof die ervoor zorgde dat ze opgeslagen calcium op een gecontroleerde manier vrijgaven en maten hoe een eiwitmodificatie, fosforylering genaamd, in de loop van de tijd veranderde. Samen stelden deze methoden hen in staat om af te leiden hoe eiwitten calcium binnen het signaalnetwerk zouden kunnen detecteren en erop reageren.
Hun aanpak leverde gegevens op over bijna elk tot expressie gebracht eiwit in de parasietcellen, maar de onderzoekers richtten zich op één bepaald eiwit genaamd Protein Phosphatase 1 (of PP1). Het eiwit is alomtegenwoordig bij veel soorten, maar is nooit eerder betrokken geweest bij calciumsignaleringsroutes. Ze ontdekten dat het eiwit geconcentreerd was aan de voorkant van de parasiet. Dit gebied van de parasietcel is betrokken bij motiliteit en gastheerinvasie.
De rol van het eiwit in de parasieten - en in de andere organismen waarin het voorkomt - is het verwijderen van de kleine moleculen die fosfaten worden genoemd uit gefosforyleerde eiwitten. "Dit is een modificatie die vaak de activiteit van individuele eiwitten kan veranderen, omdat het deze grote lading is die covalent op het oppervlak van het eiwit is geplakt," zei Lourido. "Dit wordt uiteindelijk een principe waardoor vele, vele verschillende biologische processen worden gereguleerd."
Hoe PP1 precies interageert met calcium valt nog te bezien. Toen de onderzoekers PP1 in parasietcellen uitputten, ontdekten ze dat het eiwit op de een of andere manier betrokken is bij het helpen van de parasiet om calcium op te nemen dat nodig is voor beweging. Het is onduidelijk of het daadwerkelijk calcium bindt of betrokken is bij de route via een ander mechanisme.
Omdat parasieten calciumsignalering gebruiken om veranderingen in de levenscyclus te coördineren, zoals het binnenkomen of verlaten van gastheercellen, kunnen inzichten in de belangrijkste spelers in calciumroutes een zegen zijn voor de volksgezondheid. "Dit zijn een soort van de drukpunten of de hubs die ideaal zouden zijn om op te richten om de verspreiding en pathogenese van deze parasieten te voorkomen," zei Herneisen.
Herneisen en medewerkers richtten zich voornamelijk op PP1, maar er zijn veel andere eiwitten om te onderzoeken met behulp van de gegevens van dit project. "I think part of the reason why I wanted to release this paper is so that the field could take the next steps," she said. "I'm just one person—it would be great if 20 other people find that the protein that they were studying is calcium responsive, and they can chase down the exact reason for that or how it is involved in this greater calcium signaling network. This was exciting for us with regards to PP1, and I'm sure other researchers will make their own connections." + Verder verkennen
Parasite research heats up
 Hoe te vissen op rivierkreeftjes en rivierkreeften in Oregon
Hoe te vissen op rivierkreeftjes en rivierkreeften in Oregon Wat is het maximaal mogelijke aantal Atlantische tropische cyclonen? Zie het jaar 2005
Wat is het maximaal mogelijke aantal Atlantische tropische cyclonen? Zie het jaar 2005 Zware ijzerisotopen lekken uit de kern van de aarde
Zware ijzerisotopen lekken uit de kern van de aarde Vraag en antwoord:Hoe kunnen de bosbranden van dit jaar de gletsjers in het Westen beïnvloeden?
Vraag en antwoord:Hoe kunnen de bosbranden van dit jaar de gletsjers in het Westen beïnvloeden? Oude klimaatverandering veroorzaakte opwarming die duizenden jaren duurde
Oude klimaatverandering veroorzaakte opwarming die duizenden jaren duurde
Hoofdlijnen
- Kan gentherapie kaalheid genezen?
- Onderzoekers identificeren gen om hybride tarweveredeling te helpen
- Wetenschappers ontwikkelen muggen die geen malaria kunnen verspreiden
- Een driedimensionaal DNA-model maken voor de biologie van de middelbare school
Door een model van een DNA-helix in de klas te bouwen, kunnen studenten de constructie van DNA beter visualiseren en meer te weten komen over de levengevende genetische
- San Diego Zoo pinguïn voorzien van orthopedisch schoeisel (update)
- Verschillen tussen Protozoa en Protisten
- Pesticiden en slechte voeding schaden de diergezondheid
- Een 3D-plantencel maken
- Onze darmmicroben hebben circadiane ritmes,
- Hoe de botten in het menselijk skelet te bestuderen

- Moet ik pompoentaart in de koelkast bewaren? Voedselveiligheidsinformatie voor het pompoenseizoen

- Zijn domme mensen gelukkiger?

- Wetenschappers vinden antarctische microben die alleen van lucht leven

- Wetenschappers ontdekken een nieuw mechanisme voor de export van bacteriële polysachariden
 Afbeelding:De evolutie van supernova 1987A
Afbeelding:De evolutie van supernova 1987A Als het regent, het giet - de effecten van regenwaterafvoer
Als het regent, het giet - de effecten van regenwaterafvoer Experts:in het kielzog van COVID-19, werkgevers moeten kantoren helende ruimtes maken
Experts:in het kielzog van COVID-19, werkgevers moeten kantoren helende ruimtes maken Rechtszaak hernieuwt focus op privacybeleid voor mobiele apps
Rechtszaak hernieuwt focus op privacybeleid voor mobiele apps Ingenuity Mars-helikopter zien vliegen in 3D
Ingenuity Mars-helikopter zien vliegen in 3D Een gevaarlijk gif veranderen in een biosensor
Een gevaarlijk gif veranderen in een biosensor Hoe acrylverf te maken
Hoe acrylverf te maken  Achter het dode waterfenomeen
Achter het dode waterfenomeen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

